صدها مقاله در خصوص درمان سرطان بوسیله ویروس های بهینه شده به چاپ رسیده است. سعی می کنیم آخرین مستندات علمی در خصوص ویروس درمانی را در اختیار شما قرار دهیم.
یک بررسی در سال 2019 برروی بیماران دارای سرطان مثانه مقاوم به درمان در آمریکا نشان می دهد، در تلقیح ویروس ضد سرطان به داخل مثانه تومور در تعداد قابل توجهی از بیماران بصورت کامل کنترل شده است.
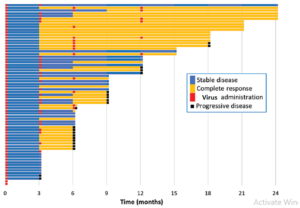
همانطور که در تصویر مشاهده می شود رنگ زرد نشان دهنده مدت زمانی است که بیماران بطور کامل به درمان پاسخ داده اند و رنگ آبی نشان دهنده جلوگیری از پیشرفت تومور در بیماران است.
راى مشاهده جزئیات درمان به لینک ذیل مراجعه نمایید.
https://www.auajournals.org/doi/10.1097/01.JU.0000556225.57786.36
در یک مطالعه که در بیمارستان مایوکلینیک آمریکا در شهر روچستر آمریکا در سال 2014 انجام شده یک بیمار دچار میولومای پیشرفته با استفاده از تزریق ویروس سرخک بهینه شده سویه واکسن بطور کامل از سرطان بهبود یافت.
از زمان انجام این مطالعه تا کنون بیمار درمان شده بوسیله ویروس درمانی دچار برگشت سرطان نشده است.
جزئیات این مطالعه را می توانید در لینک ذیل مشاهده کنید.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4225126/
ویروس ضد سرطان برای درمان گلیوبلاستوما نتایج امیدوارکنندهای را نشان میدهد که بقا را افزایش میدهد
یک مطالعه بینالمللی جدید که در مجله Nature Medicine منتشر شده و بهعنوان یک چکیده در کنفرانس سالانه انجمن جراحان مغز و اعصاب آمریکا (AANS) ارائه شده است، امید تازه ای برای درمان بیماران مبتلا به گلیوبلاستوما نشان میدهد.
دکتر فرشاد نصیری و گلاره زاده، جراحان مغز و اعصاب در شبکه بهداشت دانشگاهی (UHN) در تورنتو، نتایج یک کارآزمایی بالینی فاز 1/2 را منتشر کردند که ایمنی و اثربخشی یک درمان جدید را که ترکیبی از تزریق یک ویروس انکولیتیک (ویروسی است که با آن ترکیب میشود، بررسی میکند.) با ایمونوتراپی داخل وریدی، سلول های سرطانی را به طور مستقیم وارد تومور می کند و می کشد.
محققان دریافتند که این درمان ترکیبی جدید می تواند تومور را در بیماران منتخب با شواهدی از بقای طولانی مدت ریشه کن کند.
در تصویر ذیل کوچک شدن تومورهای مغزی بیمار پس از ویروس درمانی به خوبی نشان داده شده است.

متن کامل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
Oncolytic DNX-2401 virotherapy plus pembrolizumab in recurrent glioblastoma: a phase 1/2 trial
در یک مطالعه بالینی اثرگذاری بسیار خوب تلقیح ویروس ضد سرطان به داخل تومور سر و گردن که در آمریکا گزارش شده است. این مطالعه که در سال 2019 انجام شده تومور بیماران توسط ویروس بطور کامل کنترل شده است.
30 روزپس از تلقیح ویروس به داخل تومور
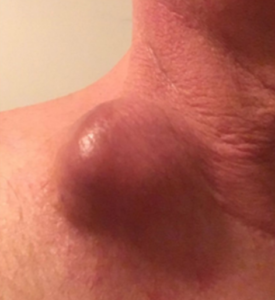
65 روز پس از تلقیح ویروس به داخل تومور
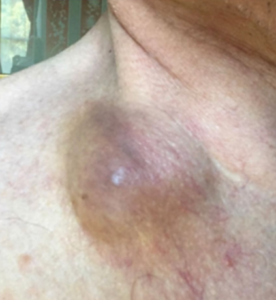
85 روز پس از تلقیح ویروس به داخل تومور
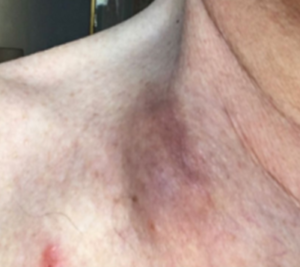
برای مطالعه این مطالعه به لینک ذیل مراجعه نمایید.
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-019-2011-3
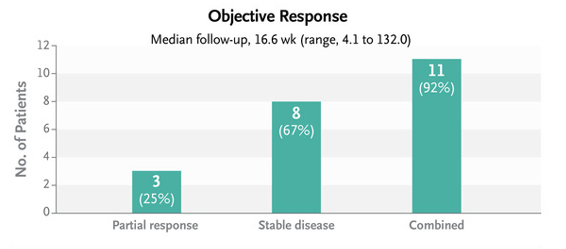
در مطالعه ای که در سال 2022 در ناوارای اسپانیا برروی کودکان مبتلا به DIPG انجام شده نشان می دهد استفاده از ویروس درمان همزمان با رادیو درمان در افزایش طول عمر کودکان تا بیش از 3 سال بسیار موثر است.
در این مطالعه کودکان 3 تا 18 سال شرکت داشتند. 3 کودک بصورت نسبی به درمان پاسخ دادند و بیماری در 8 کودک تثبیت شد.
همانطور که که گراف پایین آمده است نتایج این مطالعه رضایت بخش بوده است.
برای مطالعه کامل این تحقیق می توانید به لینک پایین مراجعه نمایید.
https://www.nejm.org/doi/full/10.1056/NEJMoa2202028
این مقاله مروری در سال 1397 نوشته شده و توضیحات مقدماتی خوبی در خصوص درمان سرطان به وسیله ویروس های مختلف را ارائه نموده است.
این مقاله برای علاقه مندان به موضوع درمان سرطان به وسیله ویروس های ضد سرطان را به راحتی و وضوح توضیح داده است.
در این مقاله با منابع علمی معتبر توضیح داده است که:
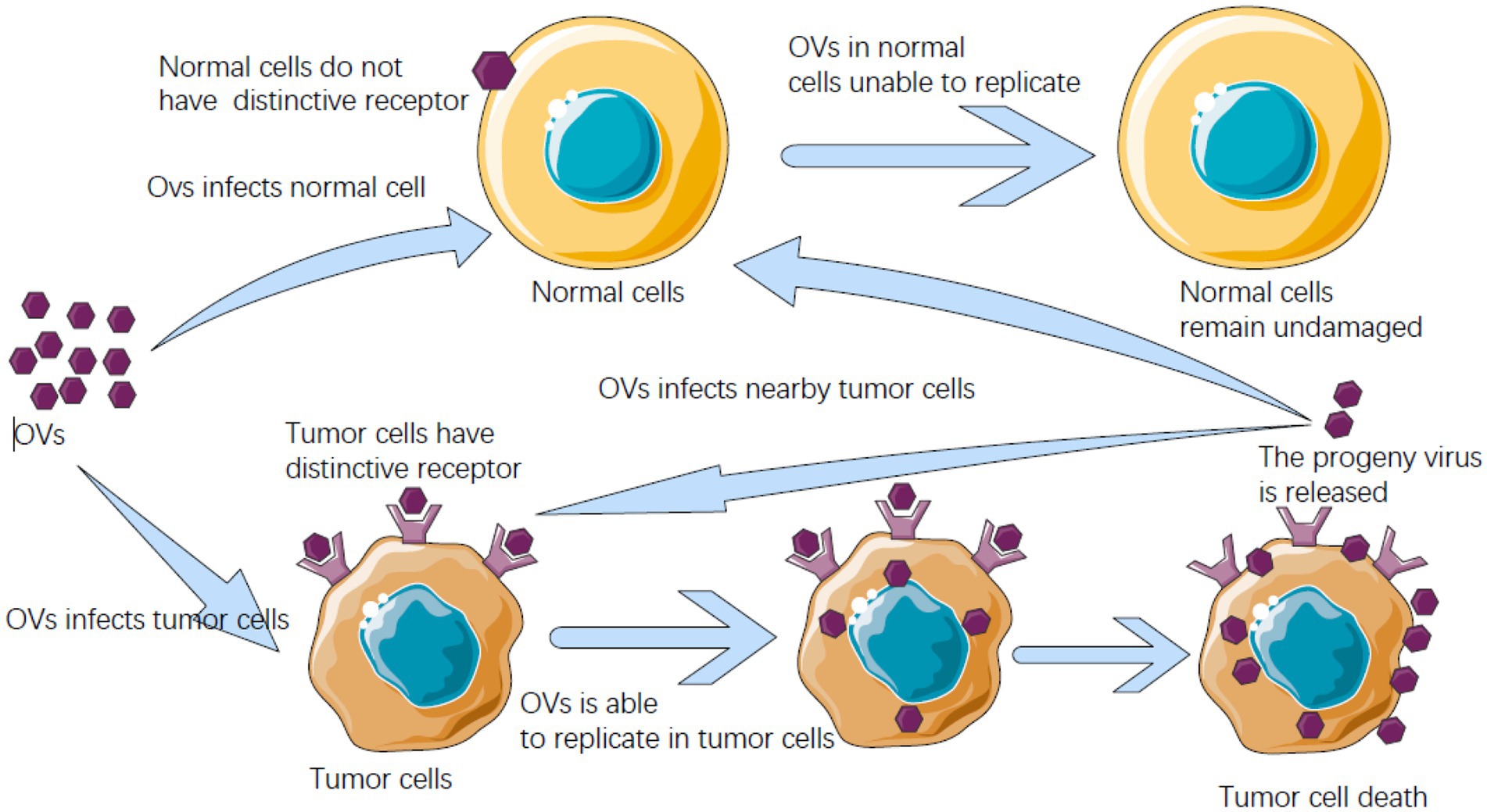
درمان ویروسی با لیز سلول های سرطانی روشی متکی بر توانایی ذاتی ویروس ها جهت آلوده کردن، تکثیر در درون و نهایتاً لیز سلول میزبان است. استفاده از ویروس ها جهت درمان سرطان به قبل از دهه 1950 بر می گردد و تا به امروز گستره ای از ویروس ها در انسان و حیوانات مختلف شناخته شده اند که کارایی آنها جهت پتانسیل ضد سرطانی و اختصاصیت شان به سرطان و همچنین ایمن بودن مورد آزمایش قرار گرفته است. از این ویروس ها میتوان به آدنو ویروس ها، ویروس هرپس سیمپلکس، سرخک، رئو ویروس، لنتی ویروس، پاروویروس، ویروس استوماتیت وزیکوالر، ویروس اوریون، ویروس بیامری آبله، ویروس واکسینیا، پارا میکسو ویروس ها اشاره کرد. این ویروس ها جهت درمان سرطان هم به شکل دست نخورده و هم با دستکاری های ژنتیکی استفاده شده اند.
در حال حاضر چندین مورد ویروس انکولیتیک نظیر ویروس هرپس سیمپلکس، ویروس واکسینیا، رئوویروس وارد فاز III آزمایش بالینی انسانی شده اند. افزون بر این، در چین، آدنوویروس انکولتیک 101H در درمان افراد مبتال به سرطان سر و گردن از سال 2005 تا به امروز اجازه استفاده یافته است.
برای مطالعه متن کامل مقاله برروی لینک ذیل کلیک نمایید.
مقاله مروری لیز سلولهای سرطانی با روش ویروسهای درمانی انکولیتیک
برای اطلاعات بیشتر در خصوص چگونگی انجام کمک به درمان سرطان بوسیله ویروس های ضد سرطان با گروه واکسوژن تماس بگیرید.
Vaxogen.ir
مقاله ای تحت عنوان
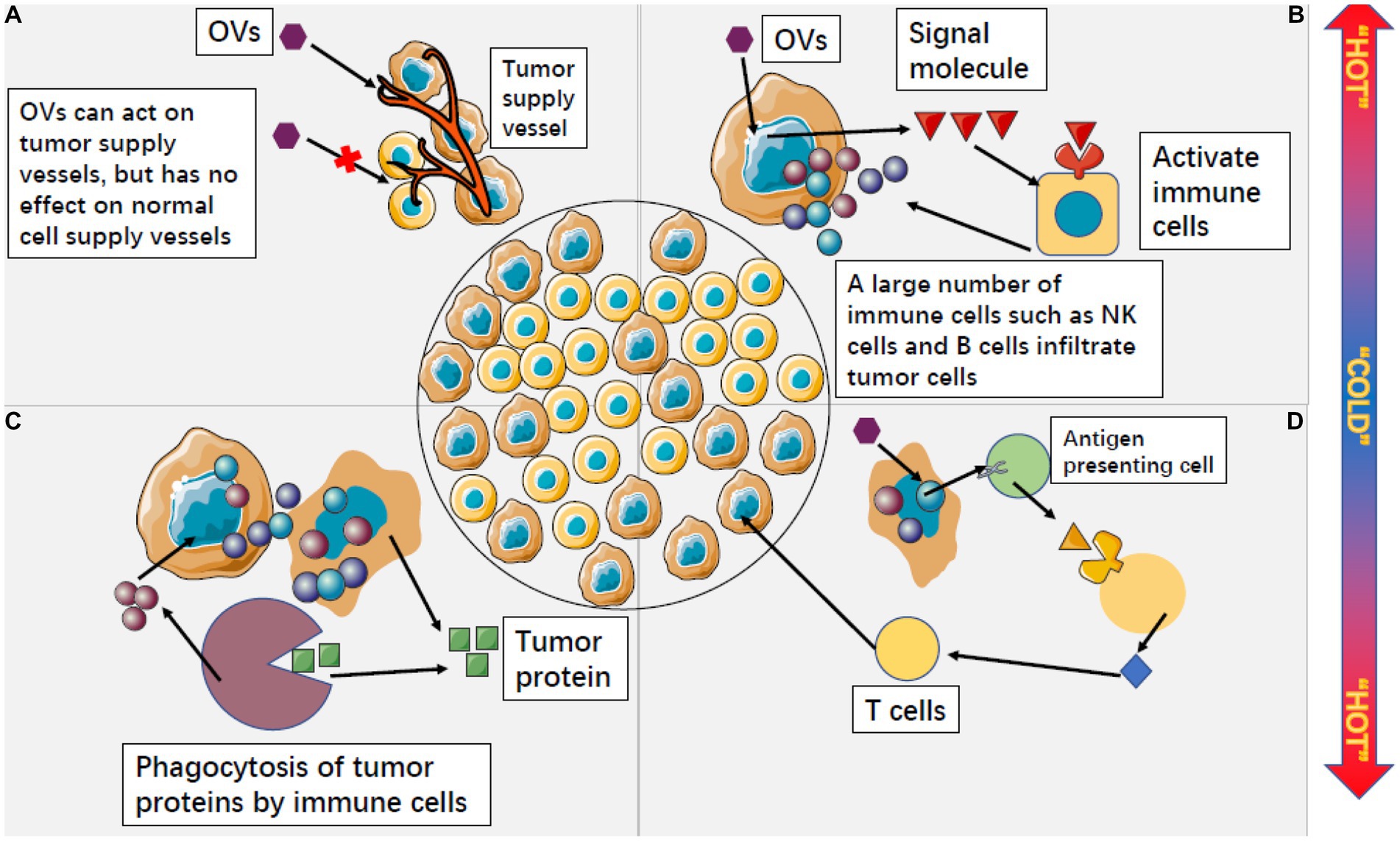
آمار آخرین کارآزمایی بالینی ویروس های ضد سرطان در این مقاله آورده شده است.
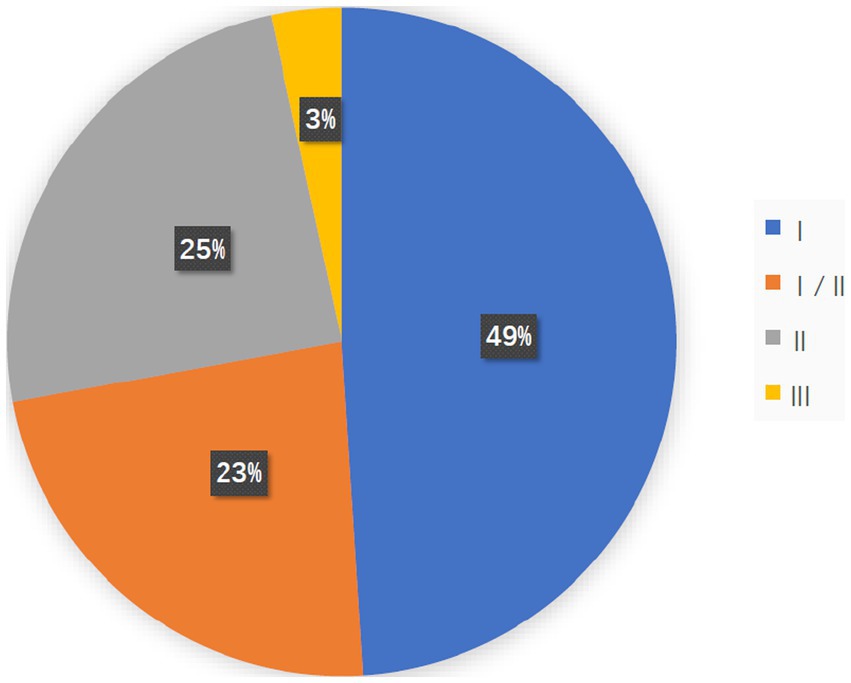
همانطور که در شکل بالا مشخص شده 147 مطالعه بالینی در خصوص ویروس های ضد سرطان در حال انجام است که 3 درصد آن در فاز 3 قرار دارد و احتمالا وارد بازار درمانی شود.
البته این آمار تا زمان چاپ مقاله است که هم اکنون افزایش یافته است.
اصل این مقاله را از لینک زیر دریافت نمایید.
برای اطلاعات بیشتر در خصوص چگونگی انجام کمک به درمان سرطان بوسیله ویروس های ضد سرطان با گروه واکسوژن تماس بگیرید.
Vaxogen.ir
در یک مطالعه بالینی در سال 2019 در سان دیاگو آمریکا ویروس حاوی واکسن را بصورت مستقیم داخل بافت توموری تلقیح گردید. نتایج این مطالعه به خوبی توانمندی ویروس ها در کنترل سرطان را نشان می دهد.
تصاویر اثرات ضد سرطانی ویروس های در ذیل بخوبی نشان داده شده است.


اصل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
First-in-human study of TK-positive oncolytic vaccinia virus delivered by adipose stromal vascular fraction cells
تا کنون صدها مطالعه بالینی در خصوص درمان سرطان بوسیله ویروس های در جهان انجام شده است.
در مقاله ای تحت عنوان Recent advances of oncolytic virus in cancer therapy توسط محققان چینی در سال 2020 چاپ شده است کارآزمایی بالینی درمان سرطان به وسیله ویروس های سرخک، هرپس، واکسینیا، رئوویروس که در جهان در حال انجام است آورده شده.
اصل این مقاله می توانید در لینک ذیل بخوانید.
کارآزمایی بالینی درمان سرطان های مختلف بوسیله ویروس آدنو
Oncolytic vector | Therapeutic agent | Cancer type | Phase, study type | Mode of therapy | Purpose of the study | Status | Clinical trial number |
DNX2401 | DNX2401 in combination with temozolomide | Recurrent glioblastoma | Phase 1, open-label, single-group study | Intra-tumoral | Safety evaluation | Completed | |
DNX2401 with interferon gamma | Recurrent glioblastoma | Phase 1b, open-label, parallel assignment | Intra-tumoral | Efficacy evaluation of DNX-2401 | Completed | ||
DNX-2401 | Diffuse pontine glioma | Phase 1, open-label, single-group study | Intra-tumoral | Safety evaluation and dose determination | Recruiting | ||
DNX-2401 in combination with pembrolizumab | Recurrent glioblastoma or gliosarcoma | Phase 2, multicenter, open-label study | Intra-tumoral DNX-2401 with intravenous pembrolizumab | Single dose efficacy evaluation of DNX-2401 | Active, not recruiting | ||
ONCOS-102 | ONCOS-102 in combination with cyclophosphamide | Advance cancers, malignant solid tumor | Phase 1, open-label, single-group study | Intra-tumoral ONCOS-102 with intravenous cyclophosphamide | Safety and dosage determination | completed | |
ONCOS-102 in combination with pemetrexed/cisplatin or cyclophosphamide | Un-resectable malignant pleural mesothelioma | Randomized phase 1b or phase2 open-label, parallel group-study | Intra-tumoral ONCOS-102 | Evaluation of safety, tolerability and efficacy of ONCOS-102 in combination with chemotherapy | Active, not recruiting | ||
ONCOS-102 in combination with pembrolizumab or cyclophosphamide | Advanced or un-resectable melanoma | Phase1, open-label, single-group study | Intra-tumoral ONCOS-102 with intra-venous pembrolizumab | Safety evaluation of sequential treatment with ONCOS-102 in combination with pembrolizumab | Recruiting | ||
VCN-01 | VCN-01 in combination with gemcitabine and Abraxane | Patients with advanced solid tumors | Phase1, open-label, single-group study | Intra-venous administration of VCN-01 with gemcitabine | Safety and tolerability evaluation of VCN-01 in combination therapy | Active, not recruiting | |
VCN-01 | Refractory retinoblastoma | Phase 1, open-label, single-group study | Intra-vitreal injection of VCN-01 | Safety and efficacy evaluation | Recruiting | ||
VCN-01 in combination with durvalumab | Recurrent head and neck squamous cell carcinoma | Phase 1, multicenter, open-label, dose-escalation study | Intra-venous injection of VCN-01 and durvalumab | Safety, tolerability and efficacy evaluation | Recruiting | ||
LOAd703 | LOAd703 in combination with gemcitabine and nab-paclitaxel | Pancreatic cancer | Open-label, single-group phase 1/2 trial | Ultra-sound guided percutaneas injection of LOAd703 | Safety evaluation | Recruiting | |
LOAd703 | Pancreatic, ovarian, biliary and colorectal cancer | Open-label, single-group, phase 1/2 study | Image-guided intra-tumoral injection of LoAd703 | Evaluation of efficacy of LOAd703 in various cancers | Recruiting | ||
ColoAd1 | ColoAd1 | Resectable colon cancer, resectable non-small cell lung cancer, bladder cancer, renal cell carcinoma | Phase 1 study | Intra-tumoral injection or intravenous infusion of ColoAd1 | Mechanism of action study | Completed | |
ColoAd1 | Solid tumor of epithelial origin, colorectal cancer, bladder cancer | Phase I, Phase II study | Sub-acute fractionated intravenous injection | Dose escalation study | Completed | ||
OBP-301 | Telomelysin (OBP-301) | Esophago gastric adenocarcinoma | Phase 2 study | Intra-tumoral | Safety and efficacy study | Recruiting | |
OBP-301 and pembrolizumab | Advanced solid tumor | Phase 1 study | Intra-tumoral | Safety and efficacy study | Recruiting | ||
OBP-301 | Hepatocellular carcinoma | Phase 1 study | Intra-tumoral | Safety and efficacy study | Recruiting | ||
OBP-301 | Melanoma Stage III/IV | Phase 2 study | Intra-lesion | Safety, efficacy evaluation | Active but not recruiting | ||
CG0070 | CG0070 | Bladder cancer (BOND2) | Phase 2 study | Intra-vesical therapy | Safety and efficacy study | Completed | |
CG0070 | Bladder cancer (ExBOND) | Phase 2 study | Intra-vesical therapy | Safety and efficacy study | Withdrawn | ||
CG0070 | Carcinoma, transitional cell bladder neoplasms | Phase 1 study | Intra-vesical therapy | Evaluation of safety and dosing of CG0070 | Current recruitment status is unknown |
کارآزمایی بالینی درمان سرطان های مختلف بوسیله ویروس سرخک
Therapeutic agent | Cancer type | Phase, study type | Mode of therapy | Purpose of the study | Status | Clinical trial number |
MV-NIS | Ovarian, fallopian or peritoneal cancer | Phase 2, open-label, randomized parallel study | Intra-peritoneal administration of MV-NIS and intravenous | Safety, tolerability and efficacy evaluation of MV-NIS in | Recruiting | |
MV-NIS in combination with cyclophosphamide | Recurrent or refractory multiple myeloma | Phase 1 and phase 2, open-label, non-randomized, parallel | Intravenous administration of MV-NIS with cyclophosphamide | Determination of maximum tolerated dose of MV-NIS in | Active, not recruiting | |
MV-NIS in combination with cyclophosphamide | Recurrent or refractory multiple myeloma | Phase 2 open-label single-group assignment | Intravenous administration of MV-NIS | Determination of the clinical efficacy of MV-NIS in | Recruiting | |
MV-NIS | Malignant pleural mesothelioma | Phase 1, open-label, single-group study | Intra-pleural administration of the oncolytic virus | Dose determination and safety evaluation | Active, not recruiting | |
MV-NIS | Head and Neck metastatic squamous cell carcinoma or | Phase1, open-label, single-group study | Intra-tumoral administration of MV-NIS | Dose determination and safety evaluation | Suspended | |
MV-NIS | Unresectable or recurrent malignant peripheral nerve | Phase 1, single-group, open-label study | Intra-tumoral administration of MV-NIS | Dose determination and safety evaluation | Recruiting | NCT02706230 |
کارآزمایی بالینی درمان سرطان های مختلف بوسیله ویروس آنکورین
Cancer type | Administration route | Groups | Patient Recovery | Adverse effects | ||||
CR | PR | SD | PD | NC | ||||
Hepatocellular carcinoma | Transartarial injection of Oncorine plus TACE | Oncorine + TACE | 28.7% | 32.2% | 26.4% | 12.6% | _ | Not reported |
TACE | 14.8% | 21.6% | 38.6% | 25% | _ | |||
Pancreatic cancer | Intratumoral (Oncorine), | Oncorine + gemitabine | _ | 15.8% | 52.6% | _ | _ | Fever and diarrhea |
Non-small-cell lung cancer (NSCLC) | Intratumoral (Oncorine), vinorelbine/cispaltin | Arm A (Oncorine+NP) | _ | 5 cases | 10 cases | 4 cases | _ | Noninfectious fever, mild pneumothorax |
Arm B (NP) | _ | 3 cases | 9 cases | 5 cases | _ | |||
Malignant pleural effusion | Intrathoracic injection of Oncorine/cisplatin | Oncorine group | 10 cases | 8 cases | _ | 3 cases | 5 cases | Leukopenia |
Cisplatin group (Control) | 8 cases | 6 cases | _ | 5 cases | 7 cases | |||
کارآزمایی بالینی درمان سرطان های مختلف بوسیله ویروس هرپس
Oncolytic Vector | Therapeutic agent | Cancer type | Phase, study type | Mode of therapy | Purpose of the study | Status | Clinical trial number |
T-VEC | T-VEC | Squamous cell carcinoma | Phase 2, single-group study | Injection of T-VEC into target lesions | efficacy evaluation | Recruiting | |
T-VEC | Melanoma | Phase Ib, open-level, multicenter, single-arm study | Intra-tumoral injection of T-VEC in combination with | To evaluate safety of T-VEC in combination with ipilimumab | Active, not recruiting | ||
Phase 2, open-label, multicenter, randomized study | Intra-tumoral injection of T-VEC in combination with | ||||||
T-VEC + pembrolizumab | Head and neck squamous cell carcinoma | Phase 1b, open-label, multicenter, randomized study | Intralesional injection of T-VEC followed by intravenous | Safety and efficacy evaluation in combination therapy | Active, not recruiting | ||
T-VEC | Unresected melanoma, stage IIIb, IV M1c | Phase 2, multicenter, single-arm study | Intralesional injection of T-VEC | Safety and tolerability evaluation | Active, not recruiting | ||
HF-10 | HF-10 + ipilimumab | Unresectable or metastatic melanoma | Phase 2, single-group assignment study | Intra-tumoral injection of T-VEC, intravenous infusion of | Efficacy and safety assessment | Completed | |
| HF-10 in combination with neoadjuvant nivolumab | Resectable stage IIIb, IIIC, IV M1a melanoma | Phase 2, open-label, single-group assignment | Intra-tumoral injection of HF-10, infusion of nivolumab | Evaluation of the safety and efficacy | Recruiting | |
HF-10 in combination with gemcitabine and Nab-paclitaxel | Unresectable pancreatic cancer, stage III or IV | Phase 1, open label, multicenter study | Intra-tumoral injection of HF-10 and intravenous infusion | To determine the appropriate dose of HF-10 treatment in | Active but not recruiting | ||
HSV-1716 | HSV-1716 | Non-central nervous system solid tumor, relapsed sarcoma | Phase 1, non-randomized, single-group assignment | Intra-tumoral | Dose-escalation study | Completed | |
HSV-1716 | Malignant pleural mesothelioma | Phase 1/IIa single-group open-label study | Intra-pleural delivery of HSV-1716 | To study the safety and tolerability and biological | Completed | ||
M03 | M03 | Recurrent malignant glioma | Phase I, single-group, open-label study | Intra-tumoral administration | To determine the safety and tolerability of the maximum | Recruiting |
Oncolytic virus-based combination therapy in breast cancer
عنوان مقاله ای است که در سال 2024 توسط محققان کانادایی در خصوص آخرین یافته های درمان سرطان پستان بوسیله ویروس های ضد سرطان منتشر نموده اند.
در این مقاله می خوانید.

مکانیسم دوگانه عمل ویروس انکولیتیک در درمان سرطان.
1) لیز مستقیم سلول های سرطانی : ویروس های انکولیتیک به طور انتخابی در سلول های سرطانی آلوده و تکثیر می شوند که منجر به تخریب نهایی سلول های آلوده می شود.
2) ویروس های ضد سرطان بوسیله تحریک سیستم ایمنی سبب تخریب سلولهای توموری می شود.
همچنین آخرین کارآزمایی بالینی درمان سرطان پستان بوسیله ویروس های ضد سرطان در این مقاله آمده است
Oncolytic virus | Combination | Route of injection | References |
Vaccinia virus | Pembrolizumab | Intratumoral | NCT04725331 |
Cyclophosphamide Avelumab | Intravenous | NCT02630368 | |
Ipilimumab | Intratumoral | NCT02977156 | |
Herpes simplex virus type 1 | Pembrolizumab | Intratumoral | NCT03004183 |
Human adenovirus | HER2-specific CAR T cells | Intratumoral | NCT03740256 |
Valacyclovir Pembrolizumab radiation therapy | Intratumoral | NCT03004183 | |
Reovirus | Monoclonal antibody targeting PD-1 | Intravenous | NCT04445844 |
Atezolizumab | Intravenous | NCT04102618 | |
Avelumab | Intravenous | NCT04215146 |
برای مطالعه متن کامل مقاله برروی لینک ذیل کلیک نمایید.
https://www.sciencedirect.com/science/article/pii/S0304383524000284
برای اطلاعات بیشتر در خصوص چگونگی انجام کمک به درمان سرطان بوسیله ویروس های ضد سرطان با گروه واکسوژن تماس بگیرید.
Vaxogen.ir
این مقاله در سال 1400 در خصوص استفاده از ویروس های در سرطان خون نوشته شده است.
با وجود پیشرفت های اخیر در زمینه پیوند سلول های بنیادی خون ساز, بروز بیماری پیوند علیه میزبان (GVHD) همچنان به عنوان یکی از پرچالش ترین عوارض پس از پیوند مطرح می باشد که با مرگ و میر قابل توجهی همراه است. راهکارهای مختلفی نظیر شیمی درمانی, تخلیه لنفوسیت های T, آنتی بادی های مونوکلونال, کورتیکواستروییدها و سایر داروهای سرکوبگر ایمنی به منظور کاهش بروز بیماری پیوند علیه میزبان استفاده می شوند که عموما موجب افزایش احتمال عود سرطان و بروز عفونت های مختلف در بیماران می شوند. مطالعات اخیر, ویروس درمانی با ویروس های انکولیتیک را به عنوان راهکاری امیدبخش در زمینه جلوگیری از بروز بیماری پیوند علیه میزبان و تقویت اثرات واکنش پیوند علیه تومور معرفی کرده اند. ویروس های انکولیتیک ویروس های غیر بیماری زایی هستند که قادر به لیز انتخابی سلول های سرطانی می باشند. این دسته از ویروس ها قادر به تفکیک اختصاصی میان لنفوسیت های T آلوژن و سلول های بنیادی خون ساز بوده و سبب ایجاد اختلال در عملکرد سلول های T آلوژن می شوند. در این مقاله مروری, مکانیسم های ویروس درمانی با ویروس های انکولیتیک در کاهش بروز بیماری پیوند علیه میزبان شرح داده شده است.
متن کامل این مقاله را می توانید در لینک های ذیل دریافت نمایید.
ویروس های انکولیتیک، یک ابزار جدید برای کاهش بیماری پیوند علیه میزبان لینک 1
ویروس های انکولیتیک، یک ابزار جدید برای کاهش بیماری پیوند علیه میزبان لینک 2
برای اطلاعات بیشتر در خصوص چگونگی انجام کمک به درمان سرطان بوسیله ویروس های ضد سرطان با گروه واکسوژن تماس بگیرید.
Vaxogen.ir
این مقاله مروری درس سال 1401 در خصوص، کمک به درمان سرطان ریه بوسیله ویروس های ضد سرطان منتشر شده است.
در این مقاله بخوبی توضیح داده شده است که:
ویروسها موجوداتی در اندازه نانو بوده که با آلوده کردن سلولهای میزبان، اختیار سنتز پروتئین میزبان را به دست گرفته و ادامه حیات سلول میزبان را رهبری میکند. سلولهای میزبان مکانیسمهای دفاعی مختلفی را جهت مقابله و محدود کردن ویروس بهکار میگیرد اما در صورت غلبه ویروس بر مکانیسمهای مذکور، سلولهای میزبان دچار مرگ برنامهریزیشده و ویروسها جهت تکثیر بیشتر آزاد میشوند. گزارشهای مختلف نشان دادهاند که اغلب عفونتهای ویروسی بهطور خودبه خودی باعث پسرفت تومور میشوند که به این مشخصه ویروسها اصطالحاً “خاصیت انکولیتیک یا لیز کنندگی تومور” اطالق میگردد. اکثر ویروسهای انکولیتیک، ویروسهای طبیعی هستند که فقط وارد سلولهای سرطانی میشوند و در آنها همانندسازی میکنند و آنها را از بین میبرند.
ویروسهای انکولیتیک یکی از استراتژیهای جدید درمان سرطان هستند و ویروسهای انکولیتیک مختلفی برای درمان موثر و ایمن سرطان توسعه یافته اند. ویروسهای انکولیتیک نه تنها مستقیما سلولهای سرطانی را لیز میکنند بلکه به طور غیرمستقیم نیز باعث تخریب رگهای خونی توموری و تقویت پاسخ ایمنی ضد تومور مخصوصی میشوند.
پتانسیل واقعی ویروسهای انکولیتیک تنها زمانی قابل درک است که در ترکیب با سایر رویکردهای درمانی مانند شیمی درمانی، درمان هدفمند و/یا پرتو درمانی مورد استفاده قرار گیرند. ترکیب ویروسهای انکولیتیک همراه با مولکولهای تحریککننده پاسخهای ضد تومور سیستم ایمنی عمدتاً به عنوان رویکردی برای تسهیل تکثیر ویروس و کشتن سلولهای توموری مقاوم به درمان مطرح میباشد.
اصل این مقاله را می توانید از لینک ذیل دریافت نمایید.
مقاله مروری فارسی: پتانسیل درمانی ویروس های انکولیتیک در درمان سرطان ریه
برای اطلاعات بیشتر در خصوص چگونگی انجام کمک به درمان سرطان بوسیله ویروس های ضد سرطان با گروه واکسوژن تماس بگیرید.
Vaxogen.ir
این مقاله فارسی در سال 1400 در خصوص استفاده از ویروس های ضد سرطان در درمان سرطان خون به چاپ رسیده است.
يكي از راهكارهاي اميدواركننده درتكميل روش هاي درماني كنوني سرطان ویروس های ضد سرطان ها مي باشند، زيرا سرطان هاي مقاوم به درمان عموماً به ویروس های ضد سرطان حساس هستندكه علت آن مكانيسم عمل متفاوت ویروس های ضد سرطان نسبت به ساير درمان هاست.
به همين دليل، هم پوشاني سميت استفاده از ویروس های ضد سرطان با ساير درمان ها بسياركم بوده و ايمني استفاده از آن ها قابل قبول است.
علي رغم آن كه اين ويروس ها عمدتا پاتوژن بودند، اما اثر قابل توجه آنها بر كاهش رشد و عوارض تومور، دانشمندان را بر آن داشت تا از ويروس هاي با پاتوژنسيته كم تر در كنترل تومورها استفاده كنند. در مورد واكسن هاي ويروسي نيز مشاهده گرديد
كه واكسن ويروس پوليو زنده ضعيف شده نتايج اميدبخشي را در كنترل گليوبلاستوماي عودكننده از خود نشان مي دهد.
اصل این مقاله را از یکی از لینکهای زیر دریافت نمایید.
برای اطلاعات بیشتر در خصوص چگونگی انجام کمک به درمان سرطان بوسیله ویروس های ضد سرطان با گروه واکسوژن تماس بگیرید.
Vaxogen.ir
این مقاله که در سال 2022 توسط محققان آمریکایی منتشر شده
پیشرفتهای بالینی درمان تومورهای مغزی بوسیله ویروسهای مختلف نشان داده شده است.
همانطور که در شکل ذیل مشخص است در سال های اخیر پیشرفتهای بالینی زیادی در زمینه درمان تومورهای مغزی بوسیله ویروس های مهندسی شده انجام گرفته است.

در جدول ذیل کارآزمایی بالینی درمان تومورهای کودکان که در جهان در حال انجام است آورده شده.
Class | Phase; Status | Delivery/ Location | Combinations | Age (Years) | Disease | Novel Aspects; Key findings | NCT |
Herpes Simplex Virus | 1; terminated | Peri- and intratumoral after tumor resection | IV dexamethasone prior to and 6 and 12 hrs post-surgery | 12–21 | Refractory/recurrent HGG | Well tolerated but trial retracted after 2 pts enrolled | |
1; completed | IT infusion over 6 hrs via 3–4 catheters | 5 Gy radiation to tumor within 24 hrs after virus | 3–18 | Progressive/recurrent supratentorial malignant glioma | First completed trial of OV for pediatric brain tumor; 12.2 month median overall survival. 5/12 patients lived ≥18 months post treatment. 108 PFU safe and tolerable. Marked increase in TILs | ||
1; recruiting | IT via catheter | 5 Gy radiation to tumor within 24 hrs of virus | 3–18 | Refractory/recurrent malignant cerebellar tumors; includes LMD | First OV delivered via catheter to the cerebellum; first trial of oHSV for infratentorial tumors | ||
2; not yet recruiting | IT infusion over 6 hrs via ≤4 catheters | 5 Gy radiation to tumor | 3–21 | Progressive/recurrent malignant HGG | First phase 2 trial of OV in children | ||
Adenovirus | 1; completed | IT infusion via catheter in cerebellar peduncle | Standard radiation and/or chemotherapy 3–4 wks after virus | 1 −18 | Naïve DIPG | Including OV as upfront therapy; | |
1b/2; recruiting | IV infusion; weekly × 8 | Radiotherapy for naïve DIPG | 1 – 21 | Naïve DIPG; Relapsed/refractory MB | Cellular therapy | ||
Poliovirus | 1b; active, not recruiting | IT infusion via intracerebral CED | 12 – 21 | Recurrent HGG/MB/ATRT | Disease involving cerebellum, pituitary, leptomeninges, brainstem, spinal cord, or requiring ventricular access can be included at discretion of neurosurgeon | ||
Reovirus | 1; active, not recruiting | IV infusion over 60 min on days 3–5 of 28-day cycle × ≤ 12 | SQ GM-CSF on days 1 and 2 of 28 day cycle. Total cycles ≤ 12 | 10–21 | Refractory/relapsed HGG/MB/ATRT/PNET | IV virus delivery | |
Measles Virus | 1; recruiting | Locally for recurrent tumors; | 1 – 39 | Disseminated or locally recurrent MB; refractory ATRT | NIS allows noninvasive spatial and temporal virus tracking |
اصل این مقاله را می توانید در لینک ذیل مطالعه نمایید.
Clinical Advances in Oncolytic Virotherapy for Pediatric Brain Tumors
همانطور که در مستد ذیل مشاهده می شود. بیمار دارای گلیوبلاستومای گرید 3 توسط ویروس های ضد سرطان درمان شده است.
تومور مغزی در بیمار پس از مرحله اول جراحی و شیمی درمانی پس از 3 سال دچار برگشت شد و از آنجاکه در جراجی دوم امکان فلج شدن بیمار وجود داشت درمان بوسیله ویروس ضد سرطان توسط بیمار انتخاب گردید.
پس از موفقیت در مرحله اول و دوم کارآزمایی بالینی درمان سرطان تخمدان توسط ویروس ضد سرطان، شرکت Genelux با همکاری 24 مرکز بالینی در آمریکا مرحله سوم بالینی درمان سرطان تخمدان بوسیله ویروس طراحی شده را آغاز نمود.
در این مطالعه بیماران دارای سرطان تخمدان بوسیله شیمی درمانی و ویروس بطور همزمان تحت درمان قرار می گیرند.
جزئیات این مطالعه را در لینک ذیل بخوانید.
file:///C:/Users/Dayan/Downloads/HollowayRWetal2022IJGCSuppl.3.pdf
ویروس چینی H101 که از ویروس آدنو درست شده است بعد از گذراندن مراحل 1 تا 3 بالینی و اثبات بی خطری و اثرگذاری برروی سلولهای سرطانی وارد مرحله چهارم بررسی در درمان تومورهای کبد پیشرفته گردید.
پس از گذراندن این مرحله ویروس ضد سرطان می تواند مجوز استفاده را دریافت نماید. NCT01503177
Zhu L, Lei Y, Huang J, An Y, Ren Y, Chen L, Zhao H, Zheng C. Recent advances in oncolytic virus therapy for hepatocellular carcinoma. Front Oncol. 2023 Apr 26;13:1172292.
در مطالعه ای در چین 40 بیمار سرطانی که درگیر انواع مختلف سرطان بودند و بخش صفاق آنها نیز درگیر شده و باعث آسیت بدخیم شده بودند، آسیت بیماران توسط تلقیح داخل صفاق ویروس تا حدود زیادی کنترل گردید.
Yalei Zhang, Ling Qian, Kun Chen, Sijia Gu, Jia Wang, Zhiqiang Meng, Ye Li, Peng Wang, Intraperitoneal oncolytic virotherapy for patients with malignant ascites: Characterization of clinical efficacy and antitumor immune response, Molecular Therapy – Oncolytics, Volume 25,2022,Pages 31-42,
همانطور که در مستد ذیل مشاهده می شود. بیمار دارای گلیوبلاستومای گرید 3 توسط ویروس های ضد سرطان درمان شده است.
تومور مغزی در بیمار پس از مرحله اول جراحی و شیمی درمانی پس از 3 سال دچار برگشت شد و از آنجاکه در جراجی دوم امکان فلج شدن بیمار وجود داشت درمان بوسیله ویروس ضد سرطان توسط بیمار انتخاب گردید.
این مقاله که در سال 2022 در آمریکا به چاپ رسیده، توانمندی ویروس ها بعنوان ادجوانت درمانی سرطان را تحلیل می نماید.
در تصویر ذیل این مقاله اثرات ویروس ضد سرطان برروی سلول توموری نمایش داده شده است

در جدول ذیل مطالعاتی که در آن ویروس درمانی بعنوان نئوادجوانت استفاده شده آمده است.
Study title | Trial number | Completion date | Reference |
|
Efficacy and safety of Talimogene Laherparepvec neoadjuvant treatment plus surgery versus surgery alone for melanoma | 22 April | |||
Biomarker analysis of neoadjuvant intralesional therapy in high-risk early melanoma Ph 2 Talimogene Laherparepvec | 24 May | |||
Neoadjuvant combination immunotherapy for stage III melanoma | 22 March | |||
A phase IIa study of neoadjuvant JX-594 (thymidine kinase-deactivated vaccinia virus plus GM-CSF) administered by intravenous infusion or intratumoral injection followed by surgical resection in patients with metastatic colorectal tumors within the liver | 13 March | |||
Neoadjuvant intravesical NIS measles virus (MV-NIS) in patients undergoing cystectomy for urothelial carcinoma but ineligible for neoadjuvant cisplatin-based chemotherapy | 22 December |
| ||
Safety and effectiveness study of G207, a tumor-killing virus, in patients with recurrent brain cancer | 3 October |
| ||
A phase 1/2 study of Talimogene Laherparepvec in combination with neoadjuvant chemotherapy in triple-negative breast cancer NCT02779855 injected directly into the tumor during chemotherapy prior to surgery | 23 August |
| ||
Stage IIIB/C/D–IV M1a melanoma with injectable disease | 23 August |
| ||
Phase II neoadjuvant trial of nivolumab in combination with HF10 oncolytic viral therapy in resectable stage IIIB, IIIC, IVM1a melanoma (Neo-NivoHF10) | 20 September |
| ||
Phase I study of intravesical recombinant fowlpox-GM-CSF (rF-GM-CSF) and/or recombinant fowlpox-TRICOM (rF-TRICOM) in patients with bladder carcinoma scheduled for cystectomy | 10 November |
|
متن کامل این مقاله را در لینک ذیل مطالعه نمایید.
The use of oncolytic virotherapy in the neoadjuvant setting
این مقاله که در سال 2021 توسط نویسندگان دانشگاه آریزونا آمریکا به چاپ رسیده و مشخصات ویروس های در حال بررسی و دارای مجوز درمانی را آورده است.
لیست ویروس های داری مجوز در ذیل آمده است.
| Name | Virus Type | Host | Year Approved | Country Approved | Indication | Background |
|---|---|---|---|---|---|---|
| Rigvir (ECHO-7) | Picornavirus | Human | 2004 | Latvia | Melanoma | Unmodified |
| Oncorine (H101) | Adenovirus serotype 5 | Human | 2005 | China | Head and neck cancer | Deleted for viral E1B-55K and with four deletions in viral E3 |
| T-VEC (Imlygic) | HSV-1 | Human | 2015 | United States and Europe | Metastatic melanoma | Deletion of ICP34.5 and ICP47; encoding two copies of human GMCSF |
| DELYTACT (teserpaturev/G47Δ) | HSV-1 | Human | 2021 | Japan | Malignant glioma or any primary brain cancer | Triple mutation (Deletion of ICP34.5, ICP6 and α47 genes) |
متن کامل این مقاله را می توانید در لینک ذیل بخوانید
Oncolytic Viruses: Newest Frontier for Cancer Immunotherapy
این مقاله مروری در سال 2022 در خصوص کمک به درمان سرطان کلورکتال بوسیله ویروس ضد سرطان به چاپ رسیده است.
در این مقاله کارآزمایی های انجام شده در زمینه درمان بوسیله ویروس آمده است.
Vaccinia virus | Study design | Case number | Clinical outcome | Ref. |
BN-CV301 | Phase I; open-label, 3 + 3 design, dose-escalation trial. | 12 | Single-agent BN-CV301 produced a confirmed partial response (PR) in 1 patient and prolonged stable disease (SD) in multiple patients. | |
rV-CEA(6D)-TRICOM/rF-CEA(6D)-TRICOM | Phase I; in Cycle 1, patients received thrice weekly s.c. injections of IFN-α-2b the week after rVCEA(6D)-TRICOM. In Cycles 2–4, patients received thrice weekly s.c. injections of IFN-α-2b the same week that rF-CEA(6D)-TRICOM was given. | 33 | No patients had a partial response, and eight patients exhibited SD of ≥3 months. Median progression-free survival and overall survival (OS) were 1.8 and 6.3 months, respectively. Significantly higher serum CD27 levels were observed after vaccine therapy and 42% of patients assayed developed CEA-specific T cell responses. | |
Pexa-Vec (JX-594) | Phase Ib; single-center, open-label. | 15 | Pexa-Vec administered as biweekly intravenous infusion was safe and well-tolerated. | |
vvDD | Phase I; open-label, dose-escalation trial using a single-dose group sequential dose-escalating design. | 16 | Intratumoral injection of the oncolytic vaccinia vvDD was well-tolerated in patients and resulted in selective infection of injected and noninjected tumors and antitumor activity. | |
vvDD | Phase I; 11 patients were treated in three dose cohorts (3 × 108 pfu, 1 × 109 pfu, or 3 × 109 pfu). vvDD was infused in 250 ml of bicarbonate-buffered saline over 1 hour. | Colon cancer 7; pancreatic cancer 2; hepatocellular carcinoma | No dose-limiting toxicities and treatment-related severe adverse events were observed. One patient | |
MVA-5T4 | Phase I/II; Patients randomized to a cyclophosphamide group received 50 mg twice daily | 55 | Cyclophosphamide depleted regulatory T cells in 24 of 27 patients receiving MVA-5T4, prolonging PFS (5.0 vs 2.5 months; hazard ratio [HR], 0.48; 95% CI, 0.21–1.11; P = .09). MVA-5T4 doubled baseline anti-5T4 responses in 16 of 35 patients, resulting in prolonged PFS (5.6 vs 2.4 months; HR, 0.21; 95% CI, 0.09–0.47; P < .001) and OS. | |
TroVax | Phase I/II; an open-label upward titration study of TroVax given to patients via i.m. injection. In addition, a single dose level of TroVax, administered i.d., was included to explore the potential effect of this route on safety and immunogenicity. | 22 | TroVax was able to boost 5T4-specific immune responses in the presence of MVA-neutralizing antibodies. A positive association between the development of a 5T4 (but not MVA) antibody response and patient survival or time to disease progression. | |
TroVax | Phase II; an open label study of TroVax administered by i.m. injection to patients with advanced colorectal cancer receiving 5-FU/folinic acid plus oxaliplatin as first-line therapy. | 17 | Administration of TroVax alongside 5-fluorouracil, folinic acid, and oxaliplatin was safe and well tolerated with no serious adverse events. Of the 11 evaluable patients, 6 had complete or partial responses. 5T4-specific immune responses, but not MVA-specific immune responses, correlated with clinical benefit. | |
TroVax | Phase II; an open label study of TroVax administered by intramuscular injection to patients with advanced colorectal cancer receiving 5-FU, leukovorin and irinotecan as Wrst line therapy. | 19 | Administration of TroVax alongside chemotherapy was safe and well tolerated with no SAEs. |
متن کامل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
The employment of vaccinia virus for colorectal cancer treatment: A review of preclinical and clinical studies
این مطالعه که در سال 2020 منتشر شده و در کشور لیتوانی انجام شده است سرطان ملانوما یک بیمار توسط جراحی و ویروس درمان تا حد زیادی کنترل شده است.
نتایج کامل این مطالعه را می توانید در لینک ذیل مطالعه نمایید.
A progressive stage IIIB melanoma treated with oncolytic ECHO-7 virus: A case report
متن کامل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
Phase I trial of intraperitoneal administration of an oncolytic measles virus strain engineered to express carcinoembryonic antigen for recurrent ovarian cancer
متن کامل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
Phase I Study of Oncolytic Vaccinia Virus GL-ONC1 in Patients with Peritoneal Carcinomatosis
متن کامل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
متن کامل این مقاله را می توانید در لینک ذیل مشاهده نمایید.
Cretostimogene grenadenorepvec is a serotype-5 oncolytic adenovirus designed to selectively replicate in cancer cells with retinoblastoma pathway alterations, previously tested as monotherapy in bacillus Calmette-Guérin (BCG)-experienced non-muscle-invasive bladder cancer. In this phase 2 study, we assessed the potential synergistic efficacy between intravesical cretostimogene and systemic pembrolizumab in patients with BCG-unresponsive non-muscle-invasive bladder cancer with carcinoma in situ (CIS). Thirty-five patients were treated with intravesical cretostimogene with systemic pembrolizumab. Induction cretostimogene was administered weekly for 6 weeks followed by three weekly maintenance infusions at months 3, 6, 9, 12 and 18 in patients maintaining complete response (CR). Patients with persistent CIS/high-grade Ta at the 3-month assessment were eligible for re-induction. Pembrolizumab was administered for up to 24 months. The primary endpoint was CR at 12 months as assessed by cystoscopy, urine cytology, cross-sectional imaging and mandatory bladder mapping biopsies. Secondary endpoints included CR at any time, duration of response, progression-free survival and safety. The CR rate in the intention-to-treat population at 12 months was 57.1% (20 out of 35, 95% confidence interval (CI) 40.7-73.5%), meeting the primary endpoint. A total of 29 out of 35 patients (82.9%, 95% CI 70.4-95.3%) derived a CR at 3 months. With a median follow-up of 26.5 months, the median duration of response has not been reached (95% CI 15.7 to not reached). The CR rate at 24 months was 51.4% (18 out of 35) (95% CI 34.9-68.0%). No patient progressed to muscle-invasive bladder cancer in this trial. Adverse events attributed to cretostimogene were low grade, self-limiting and predominantly limited to bladder-related symptoms. A total of 5 out of 35 patients (14.3%) developed grade 3 treatment-related adverse effects. There was no evidence of overlapping or synergistic toxicities. Combination intravesical cretostimogene and systemic pembrolizumab demonstrated enduring efficacy. With a toxicity profile similar to its monotherapy components, this combination may shift the benefit-to-risk ratio for patients with BCG-unresponsive CIS. ClinicalTrials.gov Identifier: NCT04387461 .
متن کامل مقاله در لینک زیر
Oncolytic adenoviral therapy plus pembrolizumab in BCG-unresponsive non-muscle-invasive bladder cancer: the phase 2 CORE-001 trial

Intravesical immunotherapy with a GM-CSF armed oncolytic vesicular stomatitis virus improves outcome in bladder cancer
ویروسهای انکولیتیک برای درمان سرطان مثانه: پیشرفتها، چالشها و چشماندازها
سرطان مثانه یکی از شایع ترین سرطان هاست. علیرغم پیشرفتهای اخیر در درمان سرطان مثانه، استراتژیهای جدید همچنان برای بهبود نتایج بیمار مورد نیاز است، بهویژه برای کسانی که نارسایی Bacille Calmette-Guerin را تجربه کردهاند و کسانی که سرطان مثانه به صورت موضعی پیشرفته یا متاستاتیک دارند. ویروسهای انکولیتیک یا بهطور طبیعی رخ میدهند یا ویروسهایی هستند که به طور هدفمند مهندسی شدهاند که توانایی آلوده کردن انتخابی و لیز سلولهای تومور را دارند و در عین حال از آسیب رساندن به سلولهای سالم جلوگیری میکنند. در پرتو این، ویروس های انکولیتیک به عنوان یک استراتژی ایمنی درمانی جدید و امیدوارکننده برای سرطان مثانه عمل می کنند. طیف گسترده ای از ویروس ها، از جمله آدنوویروس ها، ویروس هرپس سیمپلکس، کوکساکی ویروس، ویروس بیماری نیوکاسل، ویروس استوماتیت تاولی، آلفاویروس و ویروس واکسینیا، در بسیاری از مطالعات پیش بالینی و بالینی به دلیل پتانسیل آنها به عنوان عوامل انکولیتیک برای سرطان مثانه مورد مطالعه قرار گرفته اند. هدف این بررسی ارائه یک نمای کلی از پیشرفتهای ویروسهای انکولیتیک برای درمان سرطان مثانه است و چالشها و مسیرهای تحقیقاتی آینده را برجسته میکند.
متن کامل مقاله را از لینک ذیل دریافت نمایید.
Oncolytic Viruses for the Treatment of Bladder Cancer: Advances, Challenges, and Prospects