سرطان مثانه یکی از مهمترین مسائل بهداشتی و همچنین از شایعترین بدخیمی های دستگاه ادراری محسوب می شود و دومین تومور تناسلی است که باعث ابتلا و مرگ و میر درهر دو جنس زن و مرد می شود. این بیماری پرهزینه ترین درمان را نسبت به سرطانهای دیگر دارد و اپیدمیولوژی سرطان مثانه نشان می دهد که سرطان مثانه نهمین سرطان شایع تشخیص داده شده است و هرساله بیش از 380000 مورد جدید سرطان و بیش از 150000 به علت آن اتفاق میافتد. سرطان مثانه در ایران، سومین سرطان شایع در مردان است. بار جهانی سرطان مثانه در آینده روند افزایشی خواهد داشت و در ایران نیز روند بروز سرطان مثانه رو به افزایش است.
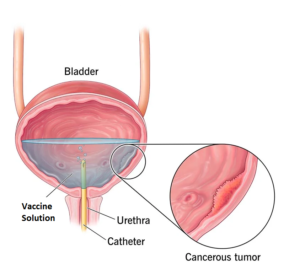
اگرچه BCG اينتراوزيکال استاندارد طلائي و مورد قبول درمان سرطان سطحي مثانه د ر طول ۳۰ سال گذشته است، اما اين درمان در ۳۰ % از افراد بي نتيجه مانده و در ۵ %عوارض جانبي ايجاد ميکند به علاوه، ۳۰ الي ۴۰ % از بيماران در طي ۵ سال پس از اين درمان دچار عود مجدد تومورها مي گردند.
بیش از صد سال است که ویروسها به عنوان عوامل درمانی برای ازبین بردن تومور مطرح شده اند. اشتیاق برای استفاده از این روش در طول زمان دچار نوسان بود و در دهه 1950و1960 به اوج خود رسید. در دهه 1980و 1970 میلادی تقریبا رها شد. اخیرا اشتیاق نسبت به استفاده از این روش افزایش یافته است.
اولین ویروس انکولایتیک که آدنو ویروس H101 بود در نوامبر 2005 مجوز فروش گرفت.
طی دهه گذشته˓ تمایل به استفاده از روش انکولایتیک وایروتراپی با استفاده از ویروسهای انکولایتیک(OV) افزایش پیدا کرده است که شامل استفاده از ویروسهایی با توانائی همانندسازی در آلوده کردن و ازبین بردن سلولهای توموری بدون آلوده کردن سلولهای سالم میباشد.
هدف اصلی این مطالعه ارائه از یک روش بی خطر و توانمند در کنار روش های درمانی موثر دیگر در کنترل تومور مثانه می باشد.
هرچند بی خطری و کارآمدی استفاده از این محصول در مطالعات جهانی اثبات شده است ولی در طی مطالعات در داخل کشور نیز با دیگر توانمندی و بی خطری محصول در مرحله آزمایشگاهی و حیوانات آزمایشگاهی مورد تایید قرار گرفت.
تا کنون تنها یک مطالعه بالینی در خصوص استفاده از ویروس های انکولیتیک در درمان سرطان مثانه در داخل کشور مجوز و کد اخلاق را دریافت نموده که با حمایت گروه واکسوژن در حال اجرا می باشد.
محصول براساس استاندارد تولید واکسن تولید می شود و محصول نهایی کلیه آزمایش های کنترل کیفی یک واکسن استاندارد را که شامل تعیین تیتر نهایی محصول، تایید استریلیتی، خلوص و … می باشد را دارد.
گروه واکسوژن برنامه جامعی برای درمان سرطان مثانه بوسیله ویروس های بی خطر ضد سرطان دارد و از همه متخصصان حوزه بالینی بخصوص متخصصان اورولوژی و انکولوژی جهت همکاری علمی و عملی دعوت می نماید
با ما تماس بگیرید.
021-88170179
0990890956
info@vaxogen.ir
در صورت داشتن هرگونه سوالی در مورد چگونگی استفاده از ویروس های هوشمند می توانید آن را با ما درمیان بگذارید.
دهها مطالعه در جهان در خصوص استفاده از ویروس های هوشمند در درمان تومورها مثانه مقاوم به درمان وجود دارد. نتایج این مطالعات نشان می دهد استفاده از ویروس های بهینه شده به همراه سایر درمان ها نتایج بسیار مناسبی در بیماران داشته است.
روش درمانی استفاده از ویروس های هوشمند در سرطان مثانه کاملا مشابه استفاده از واکسن BCG برای مبتلا به تومور مثانه است.
ویرروس های بدون خطر بصورت هفتگی به درون مثانه تلقیح می شوند.
اویروس ها تنها به رسپتورهای سطحی سلولهای سرطانی متصل شده و وارد آنها می شوند.
زمانیکه ویروس وارد سلول های سرطانی شده با تکثیر خود سبب لیز تومورها می شود و این امر باعث شناسایی سلول های سرطانی توسط سیستم ایمنی بدن می گردد.
همانطور که مطلع می باشید بسیاری از واکسن هایی که در انسان برای پیشگیری از بیماری ها استفاده می شود (مانند واکسن سرخک، سرخجه، اوریون، فلج اطفال و …) حاوی ویروس زنده و فعال می باشد.
ویروس هایی که برای درمان استفاده می شود مانند واکسن کاملا بدون خطر و ایمن می باشند.
طی آزمایش های متعدد بی خطر بودن درمان با ویرس های هوشند به اثبات رسیده است. در مطالعات گسترده ای که در کشورهای پیشرفته از ویروس های هوشمند جهت درمان بیماری ها استفاده شده است، هیچگونه بیماری مرتبط با درمان بوسیله ویروس گزارش نشده است.
- ویروس درمانی میتواند باعث تقویت عملکرد سیستم ایمنی بدن بیمار شده و از طریق تحریک منطقه ی درگیر تومور، باعث واکنش سیستم ایمنی بدن شود تا بدن بیمار از رشد و تکثیر سلول های سرطانی جلوگیری کند. بطور مثال در ویروس درمانی با ویروس بهینه شده سرخک انتظار می رود با توجه به بیان گیرنده CD46 در سطح سلول های سرطانی و تکثیر زیاد سلول های سرطانی با توجه به طراحی انجام شده، ویروس بطور اختصاصی در سلول های توموری تکثیر شده و با تخریب تومورها سبب فرخوان سیستم اینمی به محل سرطان گردد.
در ایران برای نخستین بار بررسی بالینی کمک به درمان تومور مثانه انجام گرفته و این مطالعات ادامه دارد.
بعلت محدود بودن تعداد افراد مطالعه نمی توان نتایج اثرگذاری درمان را تفسیر نمود ولی بررسی کلی بیماران که داوطلبانه ویروس های بی خطر را دریافت نمودند، نشان داده عوارض ناشی از تومور مثانه مانند درد، سوزش ادرار و خونریزی در تعداد قابل توجهی از بیماران پس ویروس درمانی به کلی مرتفع شده و این درمان باعث افزایش کیفیت زندگی آنها شده است.

تا کنون دهها مطالعه بالینی در خصوص ویروس های ضد سرطان انجام شده است. در جدول ذیل بخشی از مطالعات بالینی درمان سرطان بوسیله ویروس های ضد سرطان آورده شده است.
Clinical Study of T3011 Intravesical Instillation for Treatment of NMIBC Patients
Study Overview
Efficacy Study of Recombinant Adenovirus for Non Muscle Invasive Bladder Cancer (BOND)
Study Overview
Safety and Efficacy of CG0070 Oncolytic Virus Regimen in Patients With High Grade Non-Muscle Invasive Bladder Cancer (exBOND)
Study Overview
Study of Bacillus Calmette-Guerin (BCG) Combined With PANVAC Versus BCG Alone in Adults With High Grade Non-Muscle Invasive Bladder Cancer Who Failed At Least 1 Course of BCG
Study Overview
Background:
– Many cancers produce two particular proteins. The immune system can target these to attack the cancer. The PANVAC vaccine puts genes for these proteins inside a virus vaccine so the body sees the proteins as foreign invaders and attacks them. Researchers will test PANVAC on people with high grade non-muscle invasive bladder cancer. They will give it to people who have not responded to the usual treatment, bacillus Calmette-Guerin (BCG) over several weeks. They want to see if PANVAC plus BCG is better than BCG alone.
Objective:
– To compare the effects of PANVAC plus BCG therapy, to BCG therapy alone.
Eligibility:
– Adults 18 and older with high grade non-muscle invasive bladder cancer who failed at least 1 course of BCG.
Design:
- Participants will be screened with blood and urine tests and abdominal scans.
- Participants will be randomly assigned to get BCG only or BCG plus PANVAC.
- They will have up to 10 visits over 15 weeks. Most of these are part of usual cancer care.
- They will have blood and urine tests.
- All participants will get BCG in 6 weekly injections.
- One group will also get PANVAC in 5 injections over 15 weeks.
- Between weeks 17 and 20, participants will undergo tests of the tumor area as part of their usual care. They will have cystoscopy, exam under anesthesia, and bladder biopsy. Results will be used to evaluate the different treatments.
- Participants will have quarterly follow-up visits for up to 2 years.
Safety and Efficacy of CG0070 Oncolytic Virus Regimen for High Grade NMIBC After BCG Failure (BOND2)
Study Overview
Talimogene Laherparepvec in Treating Patients With Non-Muscle Invasive Bladder Transitional Cell Carcinoma
Study Overview
OH2 Oncolytic Viral Therapy in Advanced Bladder Cancer
Study Overview
This Ⅱ study evaluates the safety and efficacy of intratumoral injection of OH2 in locally advanced or metastatic bladder cancer.
OH2 is an oncolytic virus developed upon genetic modifications of the herpes simplex virus type 2 strain HG52, allowing the virus to selectively replicate in tumors. Meanwhile, the delivery of the gene encoding human granulocyte macrophage colony-stimulating factor (GM-CSF) may induce a more potent antitumor immune response.
This is a phase Ⅱ study evaluating the efficacy and safety of OH2 in locally advanced or metastatic bladder cancer.
BH-OH2-017 is a single-arm,multicenter clinical trial. The OH2 injection will be delivered once two weeks. In the maintenance treatment period, OH2(1x10e7 CCID50/mL) will be delivered once a month.
Adverse events (AEs) are graded according to the National Cancer Institute Common Terminology Criteria for Adverse Events (CTCAE) (version 5.0).
Radiographic imaging studies are performed using computed tomography or magnetic resonance imaging. Measurement of cutaneous or subcutaneous lesions are conducted with calipers. Evaluation of response are performed by the investigators using both the RECIST version 1.1 and the iRECIST criteria.
Study of Intratumoral REOLYSIN® in Combination With Gemcitabine and Cisplatin as Neoadjuvant Therapy in Muscle-invasive Transitional Cell Carcinoma of the Bladder
Study Overview
Reovirus Serotype 3 – Dearing Strain (REOLYSIN®) is a naturally occurring, ubiquitous, non-enveloped human reovirus. Reovirus has been shown to replicate selectively in Ras-transformed cells causing cell lysis. Activating mutations in Ras or mutations in oncogenes signaling through the Ras pathway may occur in as many as 80% of human tumors. The specificity of the reovirus for Ras-transformed cells, coupled with its relatively nonpathogenic nature in humans, makes it an attractive anti-cancer therapy candidate.
This is an open-label study of intratumoral REOLYSIN® in combination with standard of care neoadjuvant cisplatin/gemcitabine in patients with histologically and clinically confirmed muscle-invasive bladder cancer (T2-4) with or without pelvic lymph node involvement (N1-2) in Stage III and IV with no distant metastases (M0) and no prior systemic therapy for bladder cancer.
Treatment with intratumoral REOLYSIN® and chemotherapy is planned for 3 cycles followed by radical cystectomy or until unacceptable toxicity or another discontinuation criterion is met.
Two sequential treatment cohorts will be enrolled.
Patients in Cohort 1 will receive intratumoral REOLYSIN® on Cycle 1 Day 1, then 7-14 days later patients will receive intratumoral REOLYSIN® on Cycle 2 Day 1 plus intravenous neoadjuvant chemotherapy for 2 cycles (every 3 weeks) starting from Cycle 2 Day 2 followed by radical cystectomy. Three patients will be enrolled in this cohort. If there is a Dose Limiting Toxicity the cohort will be expanded to an additional 3 patients.
Upon completion of Cohort 1, Cohort 2 will be open to enrollment of 3 patients to receive 3 cycles of standard neoadjuvant chemotherapy on Day 1 and Day 8 of each cycle and intratumoral REOLYSIN® on Day 2 of each cycle (every 3 weeks). If there is a Dose Limiting Toxicity the cohort will be expanded to an additional 3 patients.
An Expansion Cohort will follow with up to 12 patients to be enrolled following either Cohort 1 or Cohort 2 treatment regimen based on the results of Cohort 1 and Cohort 2.
دهها مقاله در خصوص درمان سرطان بوسیله ویروس های بهینه شده به چاپ رسیده است. سعی می کنیم آخرین مستندات علمی در خصوص ویروس درمانی را در اختیار شما قرار دهیم.
ویروسهای انکولیتیک برای درمان سرطان مثانه: پیشرفتها، چالشها و چشماندازها
سرطان مثانه یکی از شایع ترین سرطان هاست. علیرغم پیشرفتهای اخیر در درمان سرطان مثانه، استراتژیهای جدید همچنان برای بهبود نتایج بیمار مورد نیاز است، بهویژه برای کسانی که نارسایی Bacille Calmette-Guerin را تجربه کردهاند و کسانی که سرطان مثانه به صورت موضعی پیشرفته یا متاستاتیک دارند. ویروسهای انکولیتیک یا بهطور طبیعی رخ میدهند یا ویروسهایی هستند که به طور هدفمند مهندسی شدهاند که توانایی آلوده کردن انتخابی و لیز سلولهای تومور را دارند و در عین حال از آسیب رساندن به سلولهای سالم جلوگیری میکنند. در پرتو این، ویروس های انکولیتیک به عنوان یک استراتژی ایمنی درمانی جدید و امیدوارکننده برای سرطان مثانه عمل می کنند. طیف گسترده ای از ویروس ها، از جمله آدنوویروس ها، ویروس هرپس سیمپلکس، کوکساکی ویروس، ویروس بیماری نیوکاسل، ویروس استوماتیت تاولی، آلفاویروس و ویروس واکسینیا، در بسیاری از مطالعات پیش بالینی و بالینی به دلیل پتانسیل آنها به عنوان عوامل انکولیتیک برای سرطان مثانه مورد مطالعه قرار گرفته اند. هدف این بررسی ارائه یک نمای کلی از پیشرفتهای ویروسهای انکولیتیک برای درمان سرطان مثانه است و چالشها و مسیرهای تحقیقاتی آینده را برجسته میکند.
متن کامل مقاله را از لینک ذیل دریافت نمایید.
Oncolytic Viruses for the Treatment of Bladder Cancer: Advances, Challenges, and Prospects

Intravesical immunotherapy with a GM-CSF armed oncolytic vesicular stomatitis virus improves outcome in bladder cancer
Cretostimogene grenadenorepvec is a serotype-5 oncolytic adenovirus designed to selectively replicate in cancer cells with retinoblastoma pathway alterations, previously tested as monotherapy in bacillus Calmette-Guérin (BCG)-experienced non-muscle-invasive bladder cancer. In this phase 2 study, we assessed the potential synergistic efficacy between intravesical cretostimogene and systemic pembrolizumab in patients with BCG-unresponsive non-muscle-invasive bladder cancer with carcinoma in situ (CIS). Thirty-five patients were treated with intravesical cretostimogene with systemic pembrolizumab. Induction cretostimogene was administered weekly for 6 weeks followed by three weekly maintenance infusions at months 3, 6, 9, 12 and 18 in patients maintaining complete response (CR). Patients with persistent CIS/high-grade Ta at the 3-month assessment were eligible for re-induction. Pembrolizumab was administered for up to 24 months. The primary endpoint was CR at 12 months as assessed by cystoscopy, urine cytology, cross-sectional imaging and mandatory bladder mapping biopsies. Secondary endpoints included CR at any time, duration of response, progression-free survival and safety. The CR rate in the intention-to-treat population at 12 months was 57.1% (20 out of 35, 95% confidence interval (CI) 40.7-73.5%), meeting the primary endpoint. A total of 29 out of 35 patients (82.9%, 95% CI 70.4-95.3%) derived a CR at 3 months. With a median follow-up of 26.5 months, the median duration of response has not been reached (95% CI 15.7 to not reached). The CR rate at 24 months was 51.4% (18 out of 35) (95% CI 34.9-68.0%). No patient progressed to muscle-invasive bladder cancer in this trial. Adverse events attributed to cretostimogene were low grade, self-limiting and predominantly limited to bladder-related symptoms. A total of 5 out of 35 patients (14.3%) developed grade 3 treatment-related adverse effects. There was no evidence of overlapping or synergistic toxicities. Combination intravesical cretostimogene and systemic pembrolizumab demonstrated enduring efficacy. With a toxicity profile similar to its monotherapy components, this combination may shift the benefit-to-risk ratio for patients with BCG-unresponsive CIS. ClinicalTrials.gov Identifier: NCT04387461 .
متن کامل مقاله در لینک زیر