عدم پاسخ به درمان يکي از معضلات درماني سرطان پانکراس است و در حال حاضر استراتژي قابل قبولي در خط اول درماني مطرح نشده و هنوز ترکيب دارو ها و روش های جديد، کارآمدي چنداني در بهبود وضعيت و افزايش طول عمر بيماران ندارد.
نرخ بقای پایین در بیماران مبتلا به سرطان پانکراس همچنان یک چالش بزرگ در مدیریت بالینی سرطان پانکراس است و بر نیاز فوری به توسعه رویکردهای درمانی جدید تاکید میکند.
تا چند سال پیش، ویروسها را تنها به عنوان عوامل بیماریزا میشناختند که با سرعت بالایی در سلول میزبان رشد و تکثیر مییابند. اما اکنون ویروس ها به یکی از امیدهای درمان سرطان تبدیل شده اند.
در مطالعات جدید ویروس ها در محیط آزمایشگاهی مانند یک واکسن بی خطر شده و قابلیت تخریب سلول های سرطانی در آنها ایجاد می شود.
با توجه به هوشمندی ویروس ضد سرطان، پس از ورود به بدن بیمار بطور اختصاصی وارد سلول سرطانی شده و باعث تخریب آن می شود.
تحریک سیستم ایمنی به سمت سلول سرطانی می تواند کمک بزرگی به کنترل سرطان نماید ویروس ها با تکثیر خود در سلول سرطانی سبب فراخوان سیستم ایمنی به سمت محل سلولهای سرطانی می شود.

ویروسهای ضد سرطان نمایانگر قابلیت جدید در درمان سرطان معروف به ویروس درمانی می باشند. یک درمان که به دنبال تحت کنترل درآوردن خواص طبیعی ویروسها، برای کمک به مبارزه علیه سرطان است.
گروه واکسوژن vaxogen برنامه جامعی برای درمان سرطان پانکراس بوسیله ویروس های بی خطر ضد سرطان دارد. از متخصصان گوارش و انکولوژیست جهت همکاری علمی و عملی دعوت می نماییم.
امیدواریم با توسعه تکنولوژی ویروس های هوشمند ضد سرطان در کنار درمان های استاندارد بتوانیم در بهبود سلامت و ارتقای کیفیت زندگی بیماران سهیم باشیم.
تزريق مستقیم واکسن ضد سرطان به داخل تومور پانکراس
توضیحات سرطان پانکراس بخش اول
توضیحات سرطان پانکراس بخش دوم
در ذیل به برخی سوالات بیماران در خصوص کمک درمان سرطان پانکراس بوسیله ویروس های ضد سرطان آورده شده است.
تا کنون چند نوع ویروس ضد سرطان مختلف در آمریکا و اروپا و چین مجوز استفاده در درمان سرطان های خاص در انسان را دریافت نموده اند.
همچنین در حال حاضر صدها مطالعه برروی انسان در سراسر جهان در خصوص درمان سرطان بوسیله ویروس های مختلف و بی خطر در حال انجام است.

در بسیار از موارد درمان های استاندارد توانمندی لازم جهت کنترل بیماری ندارند. در اینگونه موارد است که همراهی درمان های نوین از جمله ویروس درمانی می تواند موثر باشد.
ویروس های ضد سرطان بگونه ای طراحی شده اند که تنها در سلولهای سرطانی تکثیر شوند و آنها را از بین ببرند و در سلول های غیر سرطانی توانایی تکثیر ندارند.
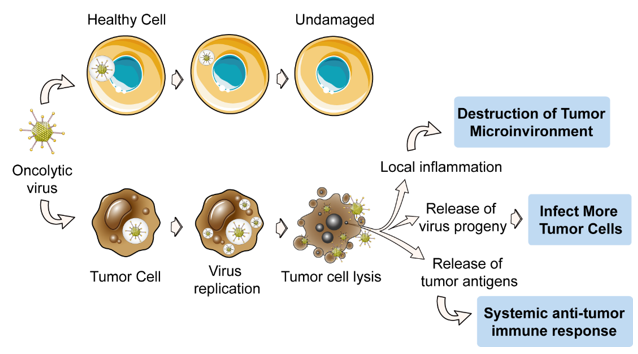
همانطور که مطلع می باشید بسیاری از واکسن هایی که در انسان برای پیشگیری از بیماری ها استفاده می شود (مانند واکسن سرخک، سرخجه، اوریون، فلج اطفال و …) حاوی ویروس زنده و فعال می باشد.
ویروس هایی که برای درمان استفاده می شود مانند واکسن کاملا بدون خطر و ایمن می باشند.
طی آزمایش های متعدد بی خطر بودن درمان با ویرس های هوشند به اثبات رسیده است. در مطالعات گسترده ای که در کشورهای پیشرفته از ویروس های هوشمند جهت درمان بیماری ها استفاده شده است، هیچگونه بیماری مرتبط با درمان بوسیله ویروس گزارش نشده است.
سرطان بیماری بسیار پیچیده است و در نتیجه درمان آن نیز به همان اندازه پیچیده می باشد.
در مطالعات مختلف نشان داده شده استفاده از یک روش درمانی نمی تواند به تنهایی در درمان سرطان موثر واقع شود. روش ویروس درمانی با مکانیسم تخریب سلولهای سرطانی و تحریک سیستم ایمنی می تواند کمک موثری به افزایش اثرگذاری سایر درمان های استاندارد جهت بهبود سرطان واقع شود.
چندین گروه تحقیقاتی در ایران در خصوص درمان سرطان بوسیله روش های نوین فعالیت می نمایند. اما بررسی ها نشان می دهد تا کنون درمان سرطان بوسیله ویروس به مرحله انسانی نرسیده است.
گروه واکسوژن موفق شده است که برای نخستین بار استفاده از ویروس بی خطر و هوشند برای کمک به بهبود سرطان پانکراس را وارد مطالعه مرحله انسانی نماید.
شرکت های دارویی پیشتاز در جهان هر کدام از یک ویروس بهینه شده برای درمان استفاده می نمایند.
بطور کلی این ویروس ها دارای توانمندی ورود به سلول های سرطانی را دارند و هیچ گونه خطری برای انسان ندارند.
یکی از بهترین ویروس هایی که در حال حاضر در آمریکا برای درمان سرطان های مختلف استفاده شده است ویروس منشا گرفته از واکسن سرخک است. این ویروس می تواند بدون ایجاد بیماری حتی در کودکان اثرگذاری مناسبی برروی سلول های سرطانی داشته باشد.
- مکانیسم اول اثرات تکثیر اختصاصی ویروس ها در سلولهای سرطانی و تخریب آنها است.
- همچنین ویروس درمانی میتواند باعث تقویت عملکرد سیستم ایمنی بدن بیمار شده و از طریق تحریک منطقه ی درگیر تومور، باعث واکنش سیستم ایمنی بدن شود تا بدن بیمار از رشد و تکثیر سلول های سرطانی جلوگیری کند. بطور مثال در ویروس درمانی با ویروس بهینه شده سرخک انتظار می رود با توجه به بیان گیرنده CD46 در سطح سلول های سرطانی و تکثیر زیاد سلول های سرطانی با توجه به طراحی انجام شده، ویروس بطور اختصاصی در سلول های توموری تکثیر شده و با تخریب تومورها سبب فرخوان سیستم اینمی به محل سرطان گردد.
از آنجکه مکانیسم ورود ویروس ها به سلول های توموری و اثرگذاری آنها با سایر روش های درمان سرطان متفاوت است، ویروس درمانی با هیچ یک از روش های معمول درمان سرطان تداخل ندارد بلکه مطالعات نشان داده درمان ویروس باعث تقویت اثرگذاری سایر روش های درمانی می شود.
آزمایش های لیپاز و آمیلاز
معمولا انجام نمی شود.
علایم سرطان پانکراس متنوع هستند. علائم زیر میتوانند نشاندهندهی سرطان پانکراس باشند:
- درد: به علت فشار تومور بر اعصاب، در ناحیهی فوقانی شکم درد متناوبی احساس میشود که به پشت منتشر میشود و باعث کمر درد نیز میشود.
- زردی یا یرقان: با گسترش سرطان لوزالمعده به مجرای صفراوی، مواد تشکیلدهندهی صفرا وارد خون شده و باعث زردشدن پوست و چشم میشوند. این انسداد در مجرای صفراوی باعث تیرهشدن مدفوع، تیرهشدن ادرار و خارش میشود.
- ازدستدادن اشتها و احساس سیری زودرس
- حالت تهوع و استفراغ
- کاهش وزن غیرقابل توجیه
- سرگیجه و ضعف
- مدفوع چرب، کمرنگ یا خاکستری
- لرز
- اسپاسم عضلانی
- اسهال
- تجمع خودبهخودی لخته در رگهای خونی عمقی دست و پا یا سایر رگهای سطحی
- افسردگی
- افزایش قند خون: به علت کاهش تولید هورمون انسولین.
اگر سرطان گسترش پیدا کند یا دچار متاستاز شود، علائم جدید با توجه به ناحیهی آسیبدیده آشکار میشود. برخی علائم نادر سرطان پانکراس که به محل درگیری بستگی دارد عبارتاند از:
- انسولینوما (تولید بیشازحد انسولین): باعث علائمی مانند عرق کردن، اضطراب، سرگیجه، غش کردن و کاهش قند خون میشود.
- گلوکاگونوما (تولید بیشازحد گلوکاگون): از علائم آن میتوان اسهال، تشنگی بیش از حد، پر ادراری و کاهش وزن را نام برد.
- گاسترینوما (تولید بیشازحد گاسترین): درد شکمی، زخم معده که میتواند باعث خونریزی گوارشی شود، ریفلاکس و کاهش وزن از علائم این نوع سرطان پانکراس است.
- سوماتوستاتینوما (تولید بیشازحد سوماتوستاتین): باعث ایجاد اسهال، کاهش وزن، درد شکمی، مدفوع چرب و بدبو میشود.
- ویپوما (تولید بیشازحد پپتید وازواکتیو روده): علائم آن شامل اسهال آبکی، درد شکمی، گرگرفتگی صورت است.
ویروس هر 15 روز یکبار توسط متخصص گوراش داخل تومور پانکراس تلقیح می گردد. تعداد دوزهای تلقیح شده در هر دوره درمانی 4 دوز است. (مدت درمان 2 ماه)
- خیر، ویروس درمانی نیز مانند شیمی درمانی، درصورت صلاحدید پزشک پس از جراحی و برداشتن بافت سرطانی و به منظور جلوگیری از عود مجدد سلول های سرطانی انجام میشود و جایگزین جراحی نمی باشد.
خیر، بیمار به صورت سرپایی دارو را دریافت نموده و بعد از گذشت 2 ساعت در صورت مساعد بودن علائم بالینی میتواند مرخص شود .
- به منظور سنجش سطح مارکرهای توموری میبایستی قبل از تزریق دارو، از بیمار آزمایش خون گرفته شود. هم چنین برای بررسی هرچه بیشتر اثرات درمانی بهتر است از بیمار سونوگرافی نیز انجام شود.
اگر عوارض شیمی شدید باشد مانند آفت دهانی و درد و بیحالی و بی اشهایی شدید، سعی بر این است تا حدامکان از همزمانی شیمی درمانی و ویروس درمانی جلوگیری شود اما بطور کل همزمانی این دو درمان مانعی ندارد .
- عوارضی مانند آنفولانزا برای بیمار ایجاد خواهد شد که عبارتند از : بی حالی، ضعف، راش پوستی ، بی اشتهایی، گرگرفتگی، تب و …..
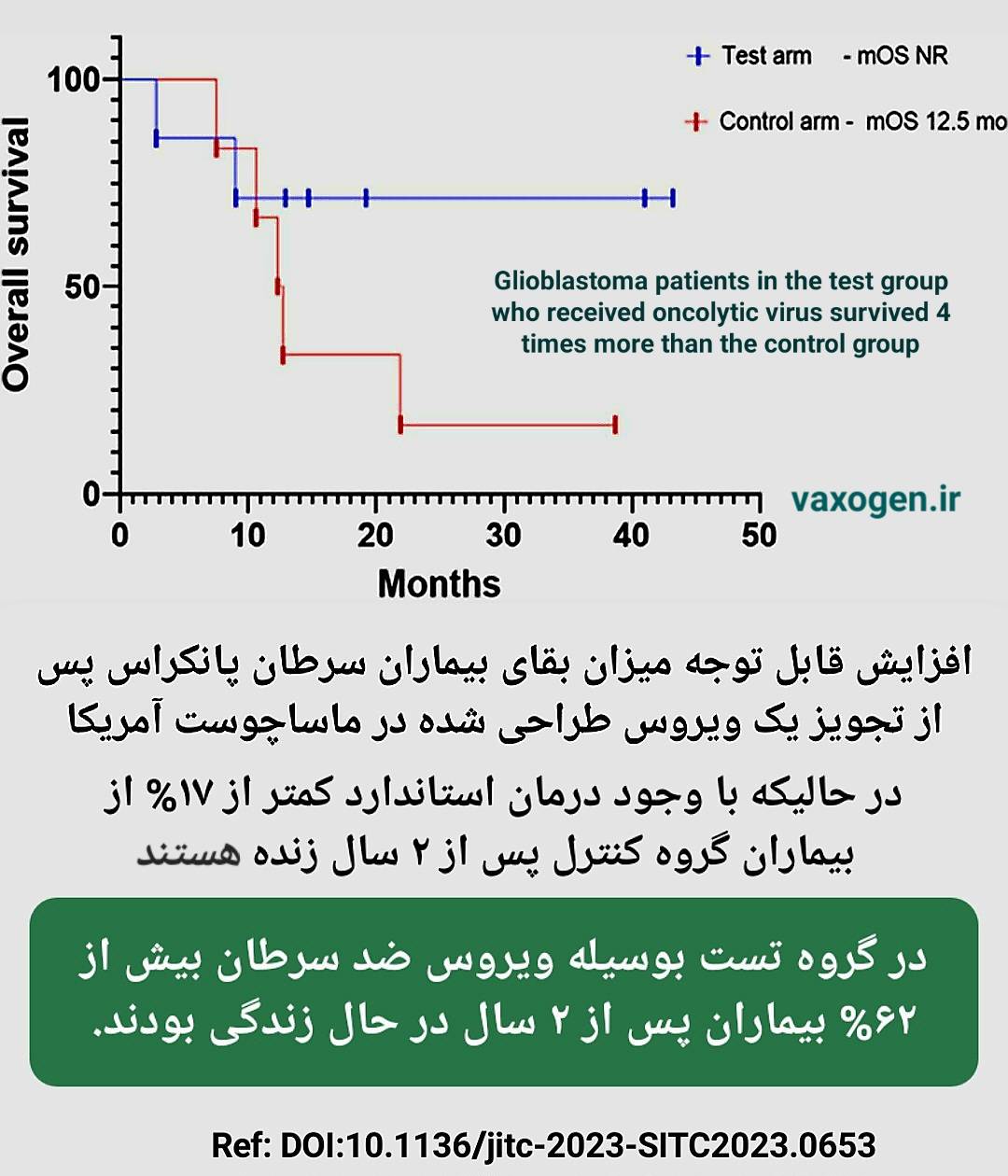


دهها کارآزمایی بالینی در خصوص کمک به درمان سرطان پانکراس بوسیله ویروس های ضد سرطان انجام شده است که در ذیل تعدادی ذکر شده
LOAd703 Oncolytic Virus Therapy for Pancreatic Cancer
The purpose of this study is to see if LOAd703 (an oncolytic adenovirus) can be safely given to patients with pancreatic cancer. The study will also evaluate whether or not intratumoral injection of LOAd703 will support current standard of care treatment to reduce the size of the tumor and improve survival of the patients.
Adenoviruses are known as the “common cold” virus and most individuals have had multiple infections during their lifetime. Oncolytic adenoviruses are adenoviruses that are modified so they cannot multiply and spread (known as replicating) properly in normal (e.g. healthy) cells, but instead, they infect and replicate very well in cancer cells. This strong replication leads to the death of the cancer cell. Oncolytic viruses have been evaluated in multiple clinical trials for cancer treatment during the past decade and been proven safe. It is common to have a fever the first day or two after virus injection since the immune system will react to the virus infection. The immune system can also kill cancer cells but to do so it needs to be properly stimulated. Oncolytic viruses alone do not seem to be strong enough to activate clinically relevant anti-cancer responses. However, it is thought that if additional immune system stimulators are added to the oncolytic viruses they may be able to result in clinical relevant antic-cancer responses.
LOAd703 is an oncolytic adenovirus that has been modified to include additional immune system stimulators. Specifically, genes that stimulate the immune system have been added to the oncolytic adenovirus. Once the oncolytic adenovirus infects the cancer cells, the genes will be expressed, resulting in activation of the immune response so it can attack and kill cancer cells.
In this study, LOAd703 will be given by intratumoral injections. It will be given in addition to standard of care treatment with gemcitabine and nab-paclitaxel +/- the anti-PD-L1 antibody atezolizumab. Because this is an experimental therapy, there will be extra visits for disease monitoring and samples accordingly to the detailed information below. The LOAd703 is an investigational agent not approved by the FDA.
The research will be conducted at Baylor College of Medicine (BCM) and Baylor St. Luke’s Medical Center (BSLMC).
All patients will receive standard of care treatment for their pancreatic cancer. Standard of care treatment will be gemcitabine in combination with nab-paclitaxel given on days 1, 8, and 15 of a 28 day cycle.
Arm 1: LOAd703 treatment will be initiated at day 15 of the first cycle and given every other week for 6 doses. Depending on the location of the tumor the injection of LOAd703 can be given in different ways. The most common route of injection is ultrasound-guided percutaneous injection, but endoscopic ultrasound-guidance will be used for some patients as appropriate. All patients will receive anti-anxiety drugs or sedation as needed for comfort during the procedure. This study evaluates different doses of LOAd703. All patients will receive six injections of LOAd703. If patients in either phase of the study are judged by the investigator to be deriving clinical benefit from LOAd703 once all scheduled injections have been administered, they will be eligible to receive up to 6 additional biweekly doses of LOAd703.
Arm 2: the same procedures as arm 1 in regard to LOAd703. In addition, the arm 2 patients will receive atezolizumab at a fixed dose, every chemotherapy cycle day 1. The treatments can continue until the final follow-up visit.
Follow-up visits: Besides visits to receive treatments, patients will continue to visit BCM/BSLMC or their local doctor for evaluation of health status and side effects. At some visits blood samples will be obtained. Some of the blood samples being obtained are considered standard of care to ensure patient safety for standard of care treatment and the LOAd703 injection. However, some blood and biopsy samples (in applicable patients) will be collected to be analyzed for the presence of LOAd703, atezolizumab tumor markers and immunology markers. The extra blood will be 5-15 ml (3 teaspoonfuls) of blood collected at the screening visit and at eight different time points both during treatment and after treatments are completed. Imaging of the tumor to determine tumor size will be done every two to three months, which is routine for the monitoring of patients with pancreatic cancer. Patients will actively participate in the study for about 9 months when the final follow-up visit will be scheduled (or 12 months if additional doses of LOAD703 are given). After their active participation is completed patients will continue to receive routine care and will be contacted by the study team every 3 months to provide follow up on the status of their disease.
Recruiting
Baylor College of Medicine
832-957-6500 blmusher@bcm.edu
713-798-4667 Monica.Francois@bcm.edu
Recruiting
Baylor St Luke’s Medical Center
832-957-6500 blmusher@bcm.edu
713-798-4667 Monica.Francois@bcm.edu
Phase I Study of TBI-1401(HF10) Plus Chemotherapy in Patients With Unresectable Pancreatic Cancer.
A Phase I, open-label, multi-center study to determine the recommended dose of TBI-1401(HF10) treatment in combination with chemotherapy (Gemcitabine + Nab-paclitaxel or TS-1) in patients with stage III or IV unresectable pancreatic cancer. Patients with stage IV must failed a gemcitabine based first-line chemotherapy.
Patients with stage III will receive the repeated intratumoral injection of TBI-1401(HF10) at recommended dose at 2-week intervals in combination with intravenous infusion of 1000 mg/m^2 Gemcitabine and 125 mg/m^2 Nab-paclitaxel at weekly for 3 weeks followed by 1 week rest.
Patients with stage IV will receive the repeated intratumoral injection of TBI-1401(HF10) at recommended dose at 2-week intervals in combination with oral of 40 – 60 mg TS-1 at twice daily for 4 weeks followed by 2 weeks rest.
Patients will receive the combination therapy of TBI-1401(HF10) + chemo for up to 1 year if eligible for treatment.
Clinical Site
Clinical Site
Clinical Site
Clinical Site
Clinical Site
Clinical Site
Clinical Site
Inclusion Criteria:
- Patients with histologically or cytologically confirmed unresectable pancreatic cancer (stage III or IV) based on the General Rules for the Study of Pancreatic Cancer (The 7th edition), and never received anti-cancer therapy (radiation therapy, chemotherapy, immunotherapy, surgery, clinical trials).
- Patients with primary lesion will be intratumorally injectable for TBI-1401(HF10) by EUS (endoscopic ultrasound).
- Patients must be ≧20 years of age.
- Patients must have at least one measurable lesion evaluated by Computed Tomography (CT) scan on RECIST ver.1.1 at pre-treatment.
- Patients must have a life expectancy ≧12 weeks.
- Patients must have an ECOG PS (Eastern Cooperative Oncology Group Performance Status) of 0-1.
- Patients demonstrated adequate organ function (≦7 days prior to treatment).
- Females of childbearing potential must have a negative urine or serum pregnancy test within 1 week prior to start of treatment.
- Patients must be able to understand the study and willing to sign a written informed consent document.
Exclusion Criteria:
- Patients receiving anti-herpes medication within 1 week prior to TBI-1401(HF10) treatment (except local treatment such as ointment).
- Patients with a significant tumor bleeding or coagulation abnormality that could not treat intratumoral injection or biopsy in safe.
- Patients with clinically evident Hepatitis B surface antigen (HBs) positive, Hepatitis C virus (HCV) antibody positive and HSV-RNA positive, Human Immunodeficiency Virus (HIV) antibody positive.
- Patients with the active symptom of Epstein-Barr virus (EBV) infection.
- Patients with active CNS metastases.
- Patients with ascites, except acceptable mild ascites.
- Patients with multiple cancer.
- Patients need to treat anticoagulant or antiplatelet agent.
- Patients has a history of allergy for CT contrast agent, live vaccine, any drug excipients, Nab-paclitaxel, Gemcitabine, or any study drugs.
Study of Nab-Paclitaxel and Gemcitabine and Plus/Minus VCN-01 in Patients With Metastatic Pancreatic Cancer (VIRAGE)
Multi-center, open label, randomized, 2-parallel arm, phase IIb study of nab-paclitaxel and gemcitabine as Standard of Care (SoC) plus/minus VCN-01 in patients with metastatic pancreatic cancer. Gemcitabine and nab-paclitaxel are chemotherapy drugs approved by the FDA to treat pancreatic cancer. VCN-01 is a genetically modified adenovirus characterized by the presence of four independent genetic modifications in the backbone of the wild-type human adenovirus serotype 5 (HAd5) genome that confer tumor selective replication and antitumor activity. Approximately 92 patients in sites in North America and European Union (EU) will be recruited and randomized in a 1:1 ratio to one of two treatment arms (i.e., approximately 46 patients per treatment arm):
- Arm 1- (SoC): Nab-paclitaxel and gemcitabine as SoC (28-day cycles). Patients in this arm will not receive the investigational medicinal product (IMP) VCN-01.
- Arm 2- (VCN-01+ SoC): A maximum of two (2) doses of VCN-01 administrated in combination with nab-paclitaxel and gemcitabine as SoC (28-day cycles with exception of the IMP dose cycles, which will be 35-day cycles).
A Data Monitoring Committee (DMC) will be convened at regular intervals to assess safety and to look at OS to determine if the trial can continue.
Oncolytic Virus Plus PD-1 Inhibitor to Patients With Advanced Pancreatic Cancer (PTCA199-8)
Pancreatic adenocarcinoma (PDAC) is a highly lethal malignancy with a 5-year survival less than 10%. Approximately 80% of patients with pancreatic cancer are diagnosed at an advanced stage. Chemotherapy is one of the major treatments for advanced pancreatic cancer. In 2011, the PRODIGE trial has shown that oxaliplatin, irinotecan, fluorouracil, and leucovorin (FOLFIRINOX) was associated with a survival advantage but had increased toxicity.
Recent studies have suggested that local destruction of tumor tissue by oncolytic virus induced activation and maturation of dendritic cells and tumor-specific T cells by cross-presentation of tumor antigens. PD-1 blocking antibody interferes with PD-1 mediated T-cell regulatory signaling. Combination of PD-1 blocking antibody plus oncolytic virus may increase anti-tumor efficacy in pancreatic cancer.
The purpose of this study is to evaluate the efficacy of oncolytic virus plus PD-1 inhibitor to patients with advanced pancreatic cancer who are refractory to standard chemotherapy. Progression-free survival (PFS), objective response rate (ORR), overall survival (OS) and disease control rate (DCR) are measured every three weeks.
Safety Study of Modified Vaccinia Virus to Cancer
This is a Phase I, open-label, single dose, dose-escalation trial in subjects with melanoma, breast cancer, or head and neck squamous cell cancer, liver, colorectal or pancreatic adenocarinoma. The intratumoral subjects will be stratified into 2 groups. Group A includes those who have been vaccinated with vaccinia virus. A history of vaccination and a scar at vaccination site is required. Group B subjects will include those who have not been vaccinated. It is expected that the toxicity profile will be quite different between those who have been vaccinated previously with vaccinia virus and therefore subjects will be stratified separately in this Phase I trial. All subjects who have refractory tumors will receive treatment at one of five dose levels in a single dose sequential dose-escalating design. Eligible subjects will receive 1 treatment of vvDD-CDSR. A dose can be divided between 1-3 lesions. The sum total of the maximal diameters of the lesion(s) to be injected must be < 10cm.
Once the MTD and/or MFD has been defined in the vaccinated I.T. arm described above, additional subject may be enrolled at one dose level lower than the MTD/MFD and the I.V. infusion phase may begin. Patients enrolled in the IV infusion arm will receive a single administration of vvDD-CDSR at one of three dose levels in a sequential dose-escalating design.
Study to Assess the Safety and Preliminary Efficacy of STI-1386 Oncolytic Virus in Relapsed or Refractory Solid Tumors
This is a Phase 1b, dose-ascending study to assess the safety, tolerability and recommended phase 2 dose (RP2D) of STI-1386 in subjects with relapsed and refractory solid tumors (RRSTs). STI-1386 is a second generation oncolytic virus.
This is a two-stage study, the first stage uses a single ascending dose, followed by the multiple ascending dose stage.
A Phase I Dose Escalation Study of Intratumoral VCN-01 Injections With Gemcitabine and Abraxane® in Patients With Advanced Pancreatic Cancer
مقالات زیادی در خصوص کمک به درمان پانکراس بوسیله ویروس های ضد سرطان منتشر شده که در ذیل تعدادی از آنها آورده شده
این مقاله در سال 2023 توسط نویسندگان کره ای نوشته شده است.
در این مقاله آمده است
سرطان پانکراس یکی از کشنده ترین سرطان ها با میزان مرگ و میر بسیار بالا است و انتظار می رود تعداد موارد به طور پیوسته با گذشت زمان افزایش یابد. سرطان لوزالمعده به دلیل فنوتیپ سرکوب کننده ایمنی و دسموپلاستیک، نسبت به گزینه های معمول درمان سرطان مانند شیمی درمانی و رادیوتراپی، و ایمونوتراپی های تجاری سازی شده مقاوم است.
با توجه به این دلایل، توسعه یک گزینه درمانی نوآورانه که می تواند بر این چالش های ناشی از ریزمحیط تومور پانکراس (TME) غلبه کند، نیاز فوری دارد. هدف بررسی حاضر خلاصه کردن تکامل آدنوویروس انکولیتیک (oAd) و استفاده به عنوان درمان (چه تک درمانی یا درمان ترکیبی) در دهه گذشته برای غلبه بر این موانع برای تحریک یک اثر ضد توموری قوی علیه سرطان لوزالمعده دسموپلاستیک و سرکوبگر سیستم ایمنی است.

همانطور که در شکل فوق آمده است ویروس بطور اختصاصی در سلول های سرطانی تکثیر می شود.
متن کامل این مقاله را می توانید از لینک ذیل دریافت نمایید.
Oncolytic adenovirus as pancreatic cancer-targeted therapy: Where do we go from here?
در این مقاله در سال 2022 منتشر شده است
در این مقاله آمده است
سرطان پانکراس (PC) یک بار جهانی در حال رشد است و یکی از کشنده ترین سرطان های دستگاه گوارش باقی مانده است. علاوه بر این، PC به درمان های مختلف مانند شیمی درمانی، رادیوتراپی و ایمونوتراپی مقاوم است. برای بهبود پیشآگهی PC به درمانهای جدید فوری نیاز است. درمان با ویروس انکولیتیک (OV) یک گزینه درمانی جدید امیدوارکننده است. OV یک ویروس اصلاح شده ژنتیکی است که به طور انتخابی در سلول های تومور تکثیر می شود. می تواند سلول های تومور را بدون آسیب رساندن به سلول های طبیعی از بین ببرد. فعال شدن سلول های T خاص تومور یک ویژگی منحصر به فرد درمان با واسطه OV است. با این حال، اثربخشی تک درمانی با واسطه OV بحث برانگیز است، به ویژه برای بیماران متاستاتیک یا پیشرفته که نیاز به درمان های قابل تحویل سیستمیک دارند. از این رو، درمان های ترکیبی برای بهبود اثربخشی درمانی درمان با واسطه OV و جلوگیری از عود تومور حیاتی خواهد بود. هدف این بررسی بررسی درمانهای ترکیبی جدید با درمان OV و بررسی مکانیسم درونی آن درمانهای ترکیبی است که امیدواریم جهت جدیدی برای پیشآگهی بهتر PC ارائه دهد.
متن کامل این مقاله را می توانید در لینک ذیل مطالعه نمایید.