سرطان مغز
تومور مغزی رشد غیر طبیعی سلولها در داخل مغز یا داخل جمجمه است که میتواند سرطانی یا غیر سرطانی (خوش خیم) باشد. به عنوان هر تومور داخل جمجمه ای که در اثر تقسیم سلولی غیرطبیعی و کنترل نشده ایجاد می شود.. تومورهای اولیه مغزی معمولاً در کودکان در حفره جمجمه خلفی و در بزرگسالان در دو سوم قدامی نیمکرههای مغزی قرار دارند ومیتوانند هر بخشی از مغز را تحت تأثیر قرار دهند. در ایالات متحده در سال 2005، تخمین زده شد که 43800 مورد جدید تومور مغزی وجود داشته است (ثبت مرکزی تومور مغزی ایالات متحده، تومورهای اولیه مغز در ایالات متحده، گزارش آماری(2005-2006) نشان میدهد که این سرطان 1.4 مورد از تمام سرطانها، 2.4 درصد از کل مرگ و میر ناشی از سرطان، و 20 تا 25 درصد از سرطانهای کودکان را شامل میشود. در نهایت، تخمین زده میشود که سالانه 13000 مرگ و میر تنها در ایالات متحده در نتیجه تومورهای مغزی رخ میدهد. بنابراین سرطان مغز سالانه هزاران نفر را مبتلا میکند و شانس زنده ماندن هر فردحداقل پنج سال کمتر از 23 درصد است. دادههای سرطان استرالیا نشان داد که سرطان مغز نهمین علت شایع مرگ و میر ناشی از سرطان در استرالیا در سال 2020 است.

گلیوبلاستوما
گلیوبلاستوما یکی از تهاجمی ترین و کشنده ترین تومورهای مغز است که هم بزرگسالان و هم کودکان را مبتلا میکند. علیرغم پیشرفتهای متعدد در زمینه زیست پزشکی، پیش آگهی گلیوبلاستوما با میانگین نرخ بقای 14 ماه پس از تشخیص که در سه دهه گذشته بوده، بهبود نیافته است و همچنان در شرایط بدی است. عوامل کمک کننده برای این پیش آگهی این بیماری عبارتند از: توسعه تهاجمی و بدون علامت گلیوبلاستوما، ناتوانی شیمی درمانی در نفوذ موثر به سد خونی مغزی (BBB)، و عود شایع گلیوبلاستوما پس از درمان. به این ترتیب نیاز فوری به توسعه درمانهای مؤثری وجود دارد که میتوانند تحویل درمانی را بهبود بخشند و در نتیجه نتایج درمان وضعیت بیمار را نیز بهبود بخشند.
گروه واکسوژنvaxogen برنامه جامعی در خصوص کمک به درمان تومورهای مغزی بوسیله ویروس های هدفمند دارد.



مقایسه اثرگذاری
واکسن ضد سرطان طراحی شده در کانادا
با واکسن ضد سرطان طراحی شده در ایران
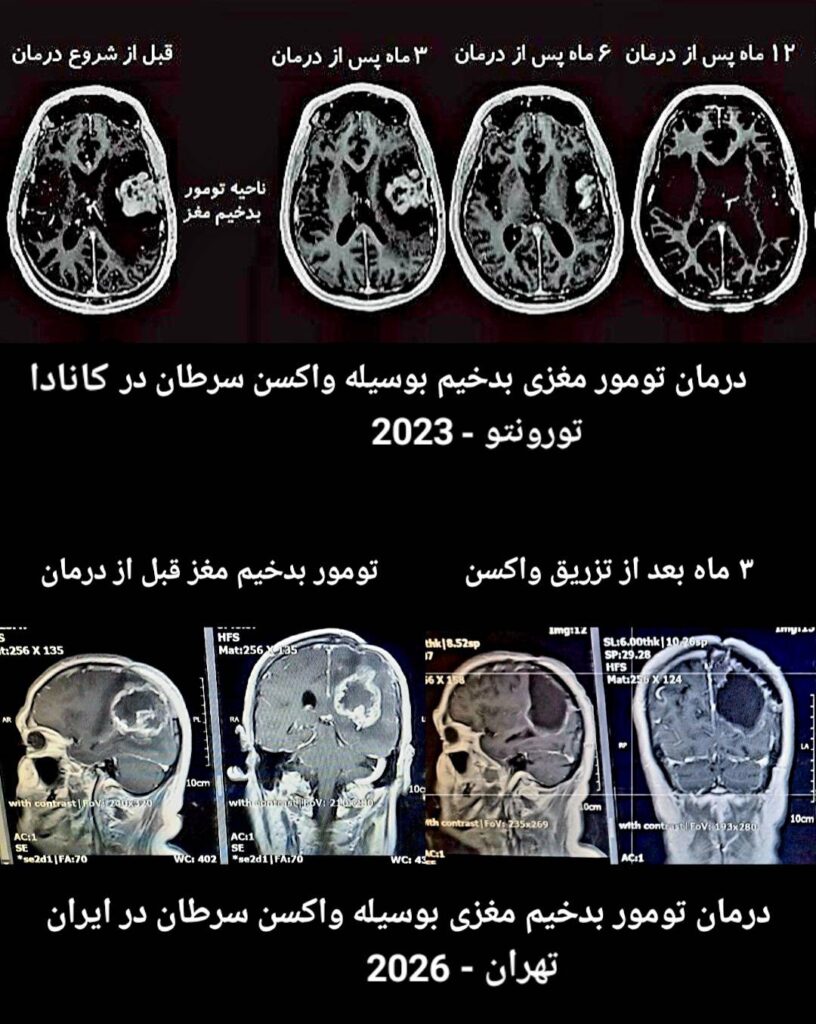

کارآزمایی بالینی کمک به درمان تومور گلیوبلاستوما بوسیله واکسن سرخک طراحی شده ضد سرطان VAXOGEN در ایران
بررسی ویروس درمانی سرطان تومور مغزی پیشرفته در فرانسه
کارازمایی بالینی وویروس درمانی تومور مغزی گلیوبلاستوما در اسپانیا
دکتر Ennio Antonio Chiocca متخصص اعصاب و رئیس بخش مغز و اعصاب بیمارستان Brigham آمریکا و مسئول طرح ویروس درمانی تومورهای مغزی
سوالات
شرکت Daiichi Sankyo موفق به طراحی یک ویروس ضد تومورهای مغزی با نام DELYTACT شده و برای آن مجوز دریافت نمودده است.

بیش از 150 مطالعه در جهان در خصوص درمان گلیوبلاستوما در جهان در حال بررسی توانمندی ویروس ها در درمان سرطان مغز است.
گزارش های منتشر شده نشان از موفقیت این روش درمان در کنترل سرطان و طول عمر بیماران دارد.
بله چندین مطالعه در مورد درمان سرطان مغز بوسیله ویروس های ضد سرطان در ایران انجام شده است و بزودی این مطالعات وارد مرحله بالینی می شود.

دهها مقاله در خصوص بررسی بالینی درمان تومورهای مغزی به چاپ رسیده که برخی از آنها در ذیل آمده است.
این مطالعه بالینی در خصوص درمان تومورهای مغز کودکان توسط ویروس های ضد سرطان است که در دپارتمان جراحی مغز دانشگاه آلاباما کار شده است.

برای مطالعه کامل این مقاله می توانید برروی لینک ذیل کلیک نمایید.
Clinical Advances in Oncolytic Virotherapy for Pediatric Brain Tumors
این مقاله در خصوص تجربه کارگذاشتن کاتاتر در داخل تومور مغزی جهت تلقیح ویروس ضد سرطان در دانشگاه آلباما آمریکا می باشد.


برای مطالعه کامل این مقاله می توانید برروی لینک ذیل کلیک نمایید.
Stereotactic Placement of Intratumoral Catheters for Continuous Infusion Delivery of Herpes Simplex Virus -1 G207 in Pediatric Malignant Supratentorial Brain Tumors
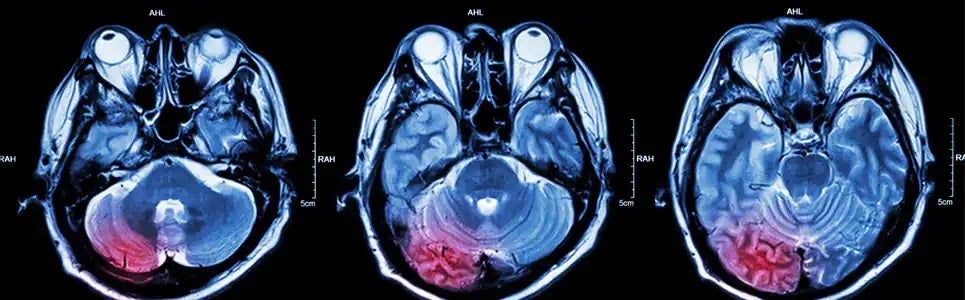
موفقیت در کنترل تومورهای مغزی توسط ویروس های ضد سرطان
همانطور در تصویر بالا مشخص شده است در یک مطالعه مشترک توسط متخصصان آلمان و اتریش با استفاده از ویروس های بهینه شده ضد سرطان، گلیوبلاستومای مولتی فرم مغزی در 4 بیمار بطور قابل توجهی کنترل گردید.تصاویر MRI مغزی بیماران بخوبی روند درمان تومورهای مغزی را نشان می دهد.

برای مطالعه کامل این مقاله می توانید برروی لینک ذیل کلیک نمایید.
Effective Treatment of Glioblastoma Multiforme With Oncolytic Virotherapy: A Case-Series

در مطالعه ای که در بیمارستان ماساچوست آمریکا صورت گرفته، ویروس های تلقیح بشده به تومور مغزی 3 بیمار مبتلا به گلیوبلاستوما باعث تغییرات شرایط تومور مغزی شده و در کمتر از 12 ماه تومور بطور کامل کنترل شده است.
همانطور که در تصویر مشخص شده پس از تلقیح ویروس ضد سرطان، تجمع سلولهای ایمنی در محل تومور باعث از بین رفتن سلولهای سرطانی شده است.
برای مطالعه کامل این مقاله می توانید برروی لینک ذیل کلیک نمایید.
Preclinical And Clinical Development Of Oncolytic Adenovirus For The Treatment Of Malignant Glioma
مطالعه بالینی کمک به درمان مدولابساتوما در کودکان بوسیله ویروس بهینه شده سرخک در آمریکا
Modified Measles Virus (MV-NIS) for Children and Young Adults With Recurrent Medulloblastoma or Recurrent ATRT
This is an open label, multi-center, Phase I study to assess the safety of administering MV-NIS directly into the tumor bed (for locally recurrent medulloblastoma or ATRT patients) or into the subarachnoid space (for disseminated recurrent medulloblastoma or ATRT patients).
For locally recurrent patients (patients in the first arm) MV-NIS will be directly administered into the tumor bed following a standard of care surgical resection. For patients with disseminated recurrence (patients in the second or third arm), MV-NIS will be injected via lumbar puncture (LP).
Patients in the second arm will receive a one-time administration of MV-NIS. Patients will be closely monitored for 30 days after injection, and then followed for evaluation of 6 month progressive free survival and overall response rate.
Patients in the third arm will receive two administrations of MV-NIS. Patients will be closely monitored for 56 days after injection, and then followed for evaluation of 4 month progressive free survival.
This is an open label, multi-center, Phase I study to assess the safety of administering MV-NIS directly into the tumor bed (for locally recurrent medulloblastoma or ATRT patients) or into the subarachnoid space (for disseminated recurrent medulloblastoma or ATRT patients).
For locally recurrent patients (patients in the first arm) MV-NIS will be directly administered into the tumor bed following a standard of care surgical resection. For patients with disseminated recurrence (patients in the second or third arm), MV-NIS will be injected via lumbar puncture (LP).
Patients in the second arm will receive a one-time administration of MV-NIS. Patients will be closely monitored for 30 days after injection, and then followed for evaluation of 6 month progressive free survival and overall response rate.
Patients in the third arm will receive two administrations of MV-NIS. Patients will be closely monitored for 56 days after injection, and then followed for evaluation of 4 month progressive free survival.
کارآزمایی بالینی کمک به درمان تومور مغزی توسط ویروس سرخک در بیمارستان مایوکلینک آمریکا در حال انجام است.
Viral Therapy in Treating Patients With Recurrent Glioblastoma Multiforme
PRIMARY OBJECTIVES:
I. To assess the safety and toxicity of intratumoral and resection cavity administration of an Edmonston’s strain measles virus genetically engineered to produce CEA (MV-CEA) in patients with recurrent glioblastoma multiforme.
II. To determine the maximum tolerated dose (MTD) of MV-CEA. III. To characterize viral gene expression at each dose level as manifested by CEA titers.
IV. To assess viremia, viral replication, and measles virus shedding/persistence following intratumoral administration.
V. To assess humoral and cellular immune response to the injected virus. VI. To assess in a preliminary fashion antitumor efficacy of this approach.
OUTLINE: This is a dose-escalation study. Patients are assigned to 1 of 2 sequential treatment arms.
ARM A (RESECTION CAVITY ADMINISTRATION): Patients undergo en block resection of their tumor (after confirming diagnosis) on day 1, followed by MV-CEA administered into the resection cavity.
ARM B (INTRATUMORAL AND RESECTION CAVITY ADMINISTRATION): Patients undergo stereotactic biopsy (to confirm the diagnosis) and placement of a catheter within the tumor, followed by carcinoembryonic antigen-expressing measles virus intratumorally (IT) through the catheter over 10 minutes on day 1. Patients then undergo en block resection of their tumor with computer-assisted stereotactic techniques on day 5, followed by MV-CEA administered around the tumor bed.
After completion of study treatment, patients are followed up at 28 days (non-cohort I patients), 7 weeks (patients in cohort I only), every 2 months until progression, every 3 and 12 months after progression, and then yearly thereafter for up to 15 years.